Introduzione

Mentre tecniche analitiche come EDX o ICP-MS forniscono un'analisi dettagliata degli elementi chimici, ad esempio quelli presenti in un campione di sale [1], i metodi di analisi termica possono essere utilizzati anche per identificare e caratterizzare i diversi composti chimici presenti in tale campione. L'analisi termica simultanea (STA), che si riferisce alla termogravimetria (TGA) e alla calorimetria differenziale a scansione (DSC) eseguite simultaneamente in un unico esperimento, è stata impiegata, ad esempio, per studiare le materie prime del cemento, compresa la presenza e l'impatto delle impurità dei sali di metalli alcalini [2]. Un altro esempio è il processo diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione e laCapacità termica specifica (cp)La capacità termica è una grandezza fisica specifica del materiale, determinata dalla quantità di calore fornita al campione, divisa per l'aumento di temperatura risultante. La capacità termica specifica è correlata all'unità di massa del campione. capacità termica specifica del materiale a cambiamento di fase (PCM) nitrato di sodio, NaNO3, che è stato studiato mediante DSC [3].
Il presente lavoro si occupa di misure STA su NaCl, KCl, il normale sale da cucina e il cosiddetto sale dell'Himalaya, concentrandosi sullaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione, l'evaporazione parziale e l'analisi compositiva dei sali. I sali alcalini come NaCl (halite) e KCl (silvite) svolgono un ruolo importante nella nostra vita quotidiana. Mentre l'NaCl è il componente principale del sale da tavola o da cucina, il KCl può essere utilizzato, ad esempio, come sale stradale in inverno. Il sale dell'Himalaya, originario del Pakistan, è un sale naturale che contiene, oltre a NaCl, diversi minerali e ossidi come il Fe2O3 [1], responsabile del colore leggermente rosa (vedi foto sopra).
Sperimentale
Le misure sono state effettuate utilizzando lo STA 449 F5 Jupiter® (vedi figura 1). Questo strumento, dotato di una fornace in SiC che consente una temperatura massima del campione di 1600°C, può essere equipaggiato opzionalmente con il sistema di cambio automatico del campione (ASC) e con tecniche di accoppiamento per l'analisi di gas evoluti come MS, FT-IR o GC-MS. L'intervallo di pesata della bilancia è di 35 g con una risoluzione di 0,1 μg sull'intero intervallo. Un altro vantaggio della STA 449 F5 Jupiter® è la funzionalità del software TG-BeFlat® che tiene automaticamente conto dell'effetto di galleggiamento, in modo da non rendere più necessarie le misure di base per i test standard.

Le condizioni di misurazione applicate per questo lavoro sono riassunte nella tabella 1.
Tabella 1: Condizioni di misura applicate per questo lavoro
Condizioni di misura | |
|---|---|
| Strumento | STA 449 F5 Jupiter® |
| Supporto del campione | TGA-DSC tipo S |
| Crogioli | PtRh (0,19 ml) |
| Velocità di riscaldamento | 10 K/min |
| Masse dei campioni | 23 ± 1 mg |
| Atmosfera | N2 |
| Portata del gas di lavaggio | 70 ml/min |
I campioni NaCl [4] e KCl [5] avevano entrambi una purezza nominale del 99,8%, mentre non erano disponibili informazioni sulla purezza del sale da cucina e del sale himalayano. Tutti i campioni sono stati misurati come un sottile strato di grani che copriva appena il fondo del crogiolo; il materiale del campione non è stato né macinato né compattato.
Risultati e discussione
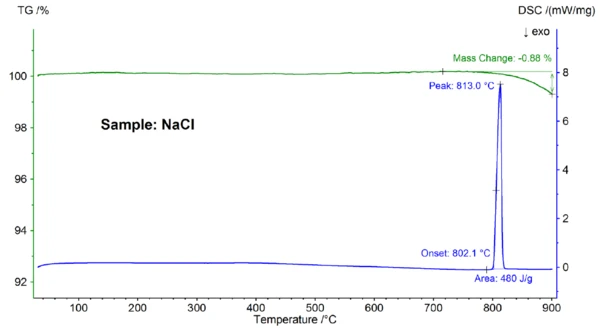
La figura 2 mostra la variazione di massa in funzione della temperatura e la velocità di flusso di calore del campione di NaCl. Alla temperatura di inizio estrapolata di 802,1°C, è stato osservato un effetto EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico con una temperatura di picco di 813°C e un'entalpia di 480 J/g, che può essere attribuito allaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione del campione. La temperatura di onset, che riflette il Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione, corrisponde bene al valore di letteratura di 801°C; anche l'entalpia di 480 J/g è in buon accordo con il valore del calore diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione di 484 J/g trovato in letteratura [6]. Al di sopra di circa 800°C si è verificata una perdita di massa dello 0,9%, dovuta a una parziale evaporazione del campione.
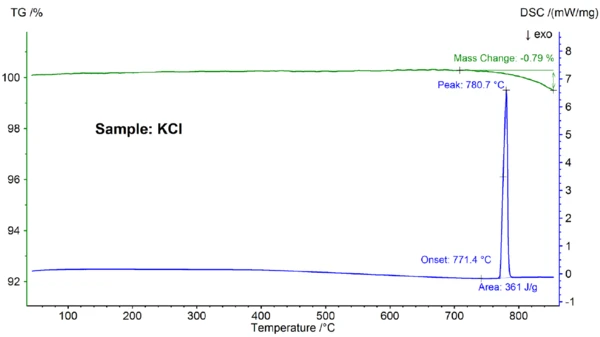
I risultati dello STA per il campione di KCl sono riportati in figura 3. Anche in questo caso sono state osservateTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione ed evaporazione parziale; il Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione, rilevato a 771,4°C, è in buon accordo con il valore di letteratura di 772°C e il valore di entalpia di 361 J/g è ancora una volta in accordo con il valore di 351 J/g riportato nel riferimento [6].
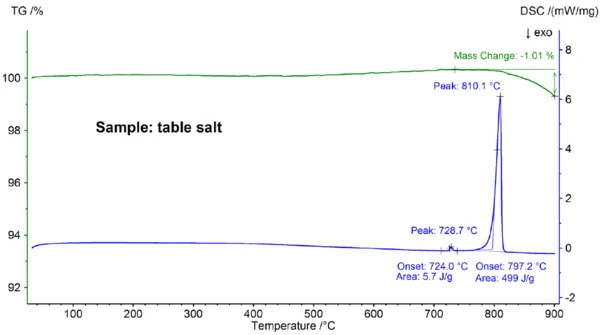
Nella figura 4 sono riportati i risultati STA ottenuti per il campione di sale da cucina, che differiscono chiaramente da quelli ottenuti per il campione di NaCl puro (confrontare le figure 4 e 2): L'insorgenza del picco principale DSC è a 797,2°C e quindi significativamente inferiore al valore di 802,1°C osservato per il NaCl puro; inoltre, è stato rilevato un ulteriore effetto EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico a una temperatura di insorgenza estrapolata di 724°C. L'entalpia dell'effetto di fusione principale, pari a 499 J/g, è nello stesso intervallo del valore di 480 J/g osservato per l'NaCl puro, mentre l'entalpia del primo effetto è di soli 6 J/g. Questi risultati dimostrano che il sale da cucina non è, come ci si aspettava, NaCl puro; la curva DSC trovata per il campione di sale da cucina è tipicamente osservata per le miscele binarie di sali [7]. In questo caso, NaI-NaCl con una concentrazione di NaI nell'intervallo percentuale più basso è il candidato più probabile [7].
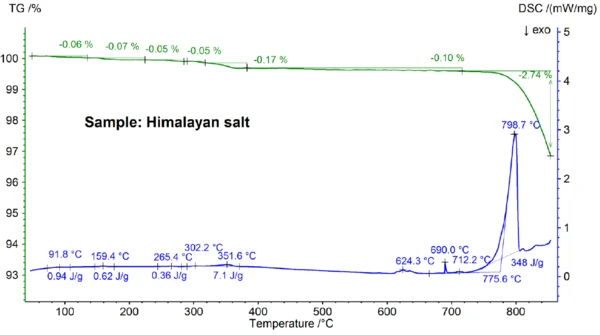
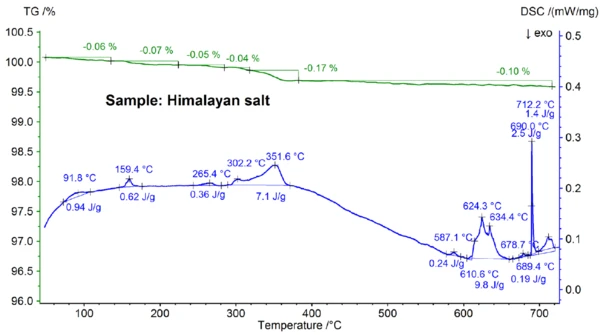
I risultati STA ottenuti per il sale himalayano, mostrati nelle figure 5a e 5b, sono ancora più complessi di quelli del sale da cucina. Ciò si può già notare nelle fasi di perdita di massa dello 0,06%, 0,07%, 0,05%, 0,05%, 0,17% e 0,10% osservate al di sotto dei 700°C solo per il campione di sale himalayano (vedi figura 5b). Al di sotto di circa 400°C, il segnale DSC ha mostrato effetti endotermici che sono correlati - e che sono dovuti alle fasi di perdita di massa; i dettagli, come le temperature di picco e le entalpie, sono visibili nella figura 5b. La perdita di massa al di sotto dei 200°C circa è probabilmente dovuta al rilascio di umidità e alla disidratazione del gesso (miscela di CaSO4∙2H2Oe CaSO4∙½H2O) con una concentrazione stimata nell'intervallo sub-percentuale. Tra i 200°C e i 400°C circa, le fasi di perdita di massa potrebbero essere dovute alla Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione di vari carbonati, mentre la fase di perdita di massa nell'intervallo di 450°C potrebbe essere dovuta alla disidratazione di Ca(OH)2. Per ulteriori interpretazioni delle fasi di perdita di massa, l'analisi dei gas evoluti sarebbe chiaramente utile [8]. Anche il risultato DSC a circa 580°C è molto complesso (vedi figura 5b): Sono stati rilevati almeno sette effetti endotermici DSC. Il picco principale a 799°C è ancora una volta molto probabilmente dovuto a una miscela binaria ricca di NaCl, come NaI-NaCl, KCl-NaCl [7] o Na2CO3- NaCl [7, 9], da cui potrebbe provenire anche il picco DSC a 712°C. I restanti effetti DSC tra 580°C e 720°C sono presumibilmente dovuti ai processi di fusione di diversi ioduri, fluoruri, cloruri, carbonati o solfati e miscele di questi con NaCl o KCl [7, 10]. Ad esempio, il picco DSC a 587°C potrebbe essere dovuto a CaI2 o K2SO4, il picco acuto a 690°C potrebbe essere dovuto a KI e il picco a 679°C potrebbe essere dovuto a una trasformazione strutturale di Fe2O3 [10]. Ulteriori dettagli, come le temperature di picco e le entalpie, sono visibili nella figura 5b. La perdita di massa del sale dell'Himalaya, pari al 2,74% al di sopra dei 700°C (vedi figura 5a), dovuta ancora una volta a un'evaporazione parziale, è significativamente più elevata rispetto a quella degli altri campioni analizzati.
Conclusione
Le indagini condotte su NaCl, KCl, sale da cucina e sale dell'Himalaya per mezzo dello STA 449 F5 Jupiter® hanno dimostrato che questo strumento è adatto allo studio di sostanze come i sali alcalini e le loro miscele. In particolare, il segnale DSC, che riflette molto chiaramente i processi di fusione e altre trasformazioni di fase, consente di indagare i diagrammi di fase attraverso le temperature di fusione e persino le entalpie. Il segnale TGA indica non solo l'evaporazione del campione, ma anche le fasi di perdita di massa dovute alla Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione, ad esempio, di sostanze impure, che possono essere identificate e quantificate in diversi casi.