Einleitung

Während analytische Verfahren wie EDX oder ICP-MS detaillierte Analysen chemischer Elemente, wie sie z.B. in einer Salzprobe vorkommen [1], ermöglichen, können thermoanalytische Methoden auch zur Identifizierung und Charakterisierung unterschiedlicher chemischer Verbindungen herangezogen werden. Die simultane thermische Analyse (STA), welche sich auf die gleichzeitige Messung von Thermogravimetrie (TG) und dynamischer Differenz-Kalorimetrie (DSC) an ein und derselben Probe bezieht, wurde bereits zur Untersuchung von Zementrohstoffen − im Besonderen hinsichtlich des Auftretens und des Einflusses von Alkalisalz-Verunreinigung − eingesetzt [2]. Ein weiteres Beispiel ist der Schmelzvorgang und die Spezifische Wärmekapazität (cp)Die spezifische Wärmekapazität oder Wärmekapazität ist eine messbare physikalische Größe, die dem Verhältnis der einem Objekt zugeführten Wärme zur resultierenden Temperaturänderung entspricht.spezifische Wärmekapazität des Wärmespeichermaterials (PCM) Natriumnitrat, NaNO3, das mittels DSC untersucht wurde [3].
Im Rahmen der Untersuchungen dieser Arbeit wurden STA-Messungen an NaCl, KCl, herkömmlichem Tafelsalz und sogenantem Himalaya-Salz durchgeführt, wobei der Schmelzvorgang, das teilweise Verdampfen und die Analyse der Zusammensetzung im Vordergrund stehen. Alkalisalze wie NaCl (Halit) und KCl (Sylvin) spielen eine wichtige Rolle in unserem täglichen Leben. Während NaCl Hauptbestandteil von Tafel- oder Kochsalz ist, wird KCl zum Beispiel im Winter als Streusalz eingesetzt. Das urspünglich aus Pakistan stammende Himalaya-Salz ist ein Natursalz, dass neben NaCl verschiedene Minerale und Oxide wie Fe2O3 enthält [1], welches für die hellrosa Farbe verantwortlich ist (siehe Foto oben).
Experimentelles
Die Messungen wurden mit der STA 449 F5 Jupiter® (siehe Abb. 1) durchgeführt. Diese Apparatur, ausgestattet mit einem SiC-Ofen, erlaubt eine maximale Probentemperatur von 1600 °C und kann optional mit einem automatischen Probenwechsler (ASC) und Kopplungstechniken für die Emissionsgasanalyse wie MS, FT-IR oder GC-MS erweitert werden. Der Wägebereich der Waage beträgt 35 g mit einer Auflösung von 0,1 μg über den gesamten Bereich.
Ein weiterer Vorteil der STA 449 F5 Jupiter® ist die Softwarefunktion TG-BeFlat®, die Auftriebseffekte automatisch berücksichtigt, sodass für Standarduntersuchungen keine Basislinienmessung mehr notwendig ist.

Die hier verwendeten Messbedingungen sind in Tabelle 1 zusammengefasst.
Tabelle 1: Messbedingungen der durchgeführten Messungen
Messbedingungen | |
|---|---|
| Gerät | STA 449 F5 Jupiter® |
| Probenträger | TG-DSC Typ S |
| Tiegel | PtRh (0,19 ml) |
| Heizrate | 10 K/min |
| Probeneinwaagen | 23 ± 1 mg |
| Atmosphäre | N2 |
| Spülgasrate | 70 ml/min |
Die Proben NaCl [4] und KCl [5] wiesen beide eine nominale Reinheit von 99,8 % auf, wohingegen für das Tafel- und Himalaya-Salz keine Informationen bezüglich der Reinheit vorlagen. Alle Proben wurde in Form einer dünnen Körnerschicht untersucht, die den Tiegelboden gerade bedeckte; das Probenmaterial wurde weder gemörsert noch verdichtet.
Ergebnisse und Diskussion
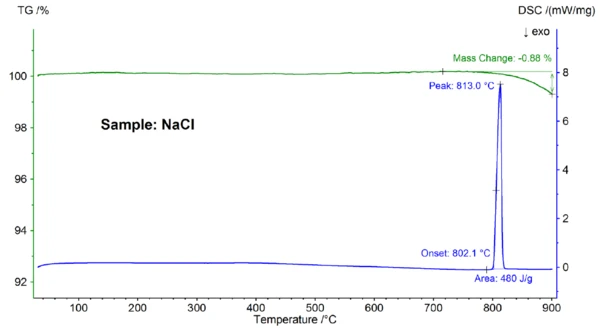
Abbildung 2 zeigt die temperaturabhängige Massenänderung und Wärmeflussrate der Probe NaCl. Bei einer extrapolierten Onsettemperatur von 802,1 °C wurde ein endothermer Effekt mit einer Peaktemperatur von 813 °C und einer Enthalpie von 480 J/g beobachtet, der auf das Schmelzen der Probe zurückzuführen ist. Die Onsettemperatur, die den Schmelzpunkt widerspiegelt, stimmt gut mit dem Literaturwert von 801 °C überein; die Enthalpie von 480 J/g ist ebenfalls in guter Übereinstimmung mit dem Literaturwert für die Reaktionswärme von 484 J/g [6]. Oberhalb von ca. 800 °C konnte ein Massenverlust von 0,9 % beobachtet werden, der dem teilweisen Verdampfen der Probe zuzuschreiben ist.
Die STA-Ergebnisse für die KCl-Probe sind in Abbildung 3 dargestellt. Wiederum konnte ein Schmelzen und teilweises Verdampfen beobachtet werden; der bei 771,4 °C detektierte Schmelzpunkt stimmt gut mit dem Literaturwert von 772 °C überein und der Enthalpiewert von 361 J/g ist wiederum in guter Übereinstimmung mit dem in Referenz [6] genannten Wert von 351 J/g.
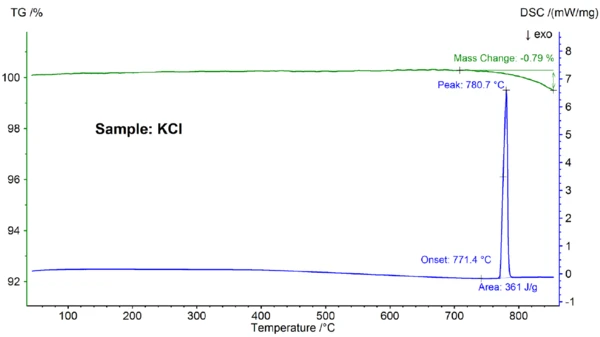
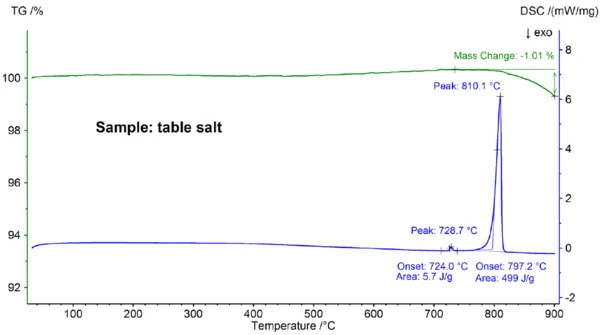
Abbildung 4 zeigt die für das Tafelsalz erhaltenen Ergebnisse, die sich eindeutig von den Ergebnisse für die reine NaCl-Probe unterscheiden (vergleiche Abbildungen 4 und 2): Der Onset des Haupt-DSC-Peaks tritt bei 797,2 °C auf und liegt somit signifikant unter dem für reines NaCl beobachteten Wert von 802,1 °C; ein weiterer endothermer Effekt wurde bei einer extrapolierten Onset-Temperatur von 724 °C detektiert. Die Enthalpie des Hauptschmelzeffekts von 499 J/g ist im gleichen Bereich wie der für reines NaCl beobachtete Wert von 480 J/g; die Enthalpie des ersten Effekts beträgt dagegen nur 6 J/g. Diese Ergebnisse bestätigen, dass es sich bei dem Tafelsalz erwartungsgemäß nicht um reines NaCl handelt; die DSC-Kurve des Tafelsalzes wird typischerweise für binäre Salzmischungen beobachtet [7]. In diesem Fall ist ist NaI-NaCl mit einer Konzentration von NaI im unteren Prozentbereich der wahrscheinlichste Kandidat [7].
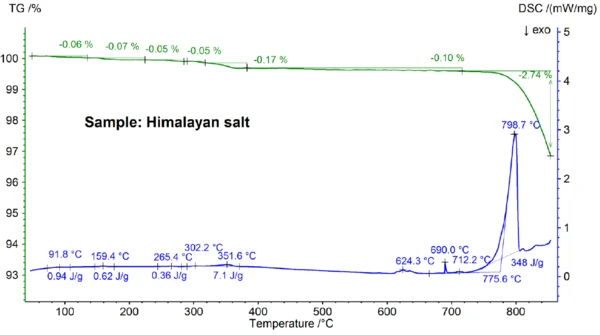
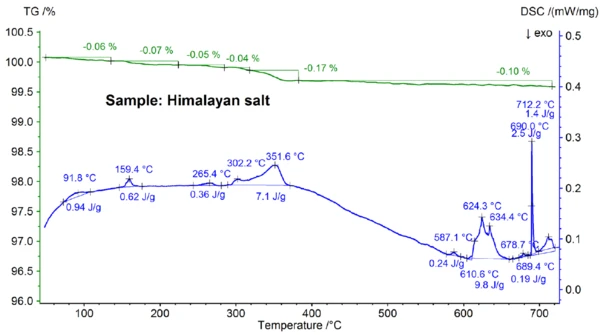
Die für das Himalay-Salz in Abbildungen 5a und 5b gezeigten STA-Ergebnisse sind noch komplexer als die Messergebnisse für das Tafelsalz. Dies ist bereits an den Massenverluststufen von 0,06 %, 0,07 %, 0,05 %, 0,05 %, 0,17 % und 0,10 % erkennbar, die nur für das Himalaya-Salz unterhalb 700 °C erhalten wurden (Abb. 5b). Unterhalb ca. 400 °C zeigt das DSC-Signal endotherme Effekte, die mit den Massenverluststufen korrelieren und auf diese zurückzuführen sind; Einzelheiten wie Peaktemperaturen und Enthalpien sind der Abbildung 5b zu entnehmen. Der Massenverlust unterhalb von ca. 200 °C ist wahrscheinlich auf die Abgabe von Feuchtigkeit und die Entwässerung von Gips (Mischung aus CaSO4∙2H2O und CaSO4∙½H2O) zurückzuführen mit einer geschätzten Konzentration im Sub-Prozentbereich. Die Massenverluststufen zwischen ca. 200 °C und 400 °C könnten von der Zersetzung verschiedener Carbonate stammen, während die Massenverluststufe im Bereich von 450 °C auf die Enwässerung von Ca(OH)2 zurückzuführen sein könnte. Für weitere Interpretationen der Massenverluststufen wäre eine Emissionsgasanalyse sicherlich sehr hilfreich [8]. Auch das DSC-Ergebnis oberhalb ca. 580 °C ist sehr komplex (Abb. 5b): Es wurden mindestens sieben endotherme DSC-Effekte detektiert. Der Hauptpeak bei 799 °C geht höchstwahrscheinlich wieder auf eine binäre NaCl-reiche Mischung wie NaI-NaCl, KCl-NaCl [7] oder Na2CO3-NaCl [7, 9] zurück, von der auch der DSC-Peak bei 712 °C herrühren könnte. Man kann davon ausgehen, dass die restlichen DSC-Effekte zwischen 580 °C und 720°C den Schmelzvorgängen unterschiedlicher Jodide, Chloride, Carbonate oder Sulfate sowie Mischungen aus diesen mit NaCl oder KCl zuzuschreiben sind [7, 10]. So könnte beispielsweise der DSC-Peak bei 587 °C auf CaI2 oder K2SO4, der scharfe Peak bei 690 °C auf Kl und der Peak bei 679 °C auf eine strukturelle Umwandlung von Fe2O3 [10] zurückzuführen sein. Weitere Einzelheiten wie Peaktemperaturen und -enthalpien sind aus der Abbildung 5b ersichtlich. Der Massenverlust des Himalaya-Salzes von 2,74 % oberhalb 700 °C (siehe Abb. 5a), der wiederum von der teilweisen VerdampfungVerdampfung beschreibt die Phasenumwandlung eines Stoffes von der flüssigen in die gasförmige Phase. Beim Verdampfen eines Stoffes unterscheidet man grundsätzlich zwei Formen, Sieden und Verdunstung.Verdampfung herrührt, ist beträchtlich höher als bei den anderen untersuchten Proben.
Zusammenfassung
Die Messungen an NaCl, KCl, Tafelsalz und Himalaya-Salz mit der STA 449 F5 Jupiter® haben gezeigt, dass diese Appararatur gut geeignet ist, um Substanzen wie Alkalisalze und deren Mischungen zu untersuchen. Besonders das DSC-Signal, das Schmelzprozesse und andere Phasenumwandlungen deutlich widerspiegelt, erlaubt die Untersuchung von Phasendiagrammen mittels Schmelztemperaturen und SchmelzenthalpienDie Schmelzenthalpie einer Substanz, auch bekannt als latente Wärme, stellt ein Maß der Energiezufuhr dar, typischerweise Wärme, welche notwendig ist, um eine Substanz vom festen in den flüssigen Zustand zu überführen. Der Schmelzpunkt einer Substanz ist die Temperatur, bei der die Substanz von einem festen (kristallinen) in den flüssigen Zustand (isotrope Schmelze) übergeht.Schmelztemperaturen und sogar -enthalpien. Das TG-Signal zeigt nicht nur das Verdampfen einer Probe, sondern auch Massenverluststufen aufgrund der Zersetzung, z.B. von Verunreinigungen, die in einigen Fällen identifiziert und quantifiziert werden können.