Einleitung
Oxalate sind die Salze der Oxalsäure C2H2O4 (COOH)2 (Ethandicarbonsäure). Das Calciumsalz der Oxalsäure, das Calciumoxalat, kristallisiert wasserfrei und als Solvat mit einem Molekül Wasser pro Formeleinheit, als Calciumoxalat- Monohydrat CaC2O4*H2O.
Vorkommen und Verwendung
Obwohl Calciumoxalat-Monohydrat das Salz einer organischen Säure ist, kommt es in der Natur als Primärmineral vor. Abbildung 1 zeigt einen Whewellitkristall aus Schlema im Erzgebirge. Neben dem Whewellit ist noch der Weddellit als zweite mineralische Spezies bekannt [1].

Calciumoxalat ist ferner der Hauptbestandteil von Nierensteinen.
In der Thermischen Analyse wird Calciumoxalat-Monohydrat zur Funktionsüberprüfung von Thermowaagen eingesetzt. Die Substanz ist lagerstabil, unterliegt somit keiner zeitlichen Veränderung und neigt auch nicht dazu, Feuchtigkeit aus der Laboratmosphäre zu adsorbieren. Damit ist es eine ideale Vergleichssubstanz für die temperaturabhängige Überprüfung einer Thermowaage.
Messbedingungen
- Instrument
- TG 209 F1 Libra®
- Probe
- CaC2O4*H2O
- Einwaagen
- 8,43 mg (schwarze Kurve in Abbildung 2) und
- 8,67 mg (rote Kurve in Abbildung 2)
- Tiegel
- Al2O3
- Atmosphäre
- Stickstoff
- Gasflussrate
- 40 ml/min
- Heizrate
- 10 K/min (schwarze Kurve in Abbildung 2) und
- 200 K/min (rote Kurve in Abbildung 2)
Thermogravimetrie
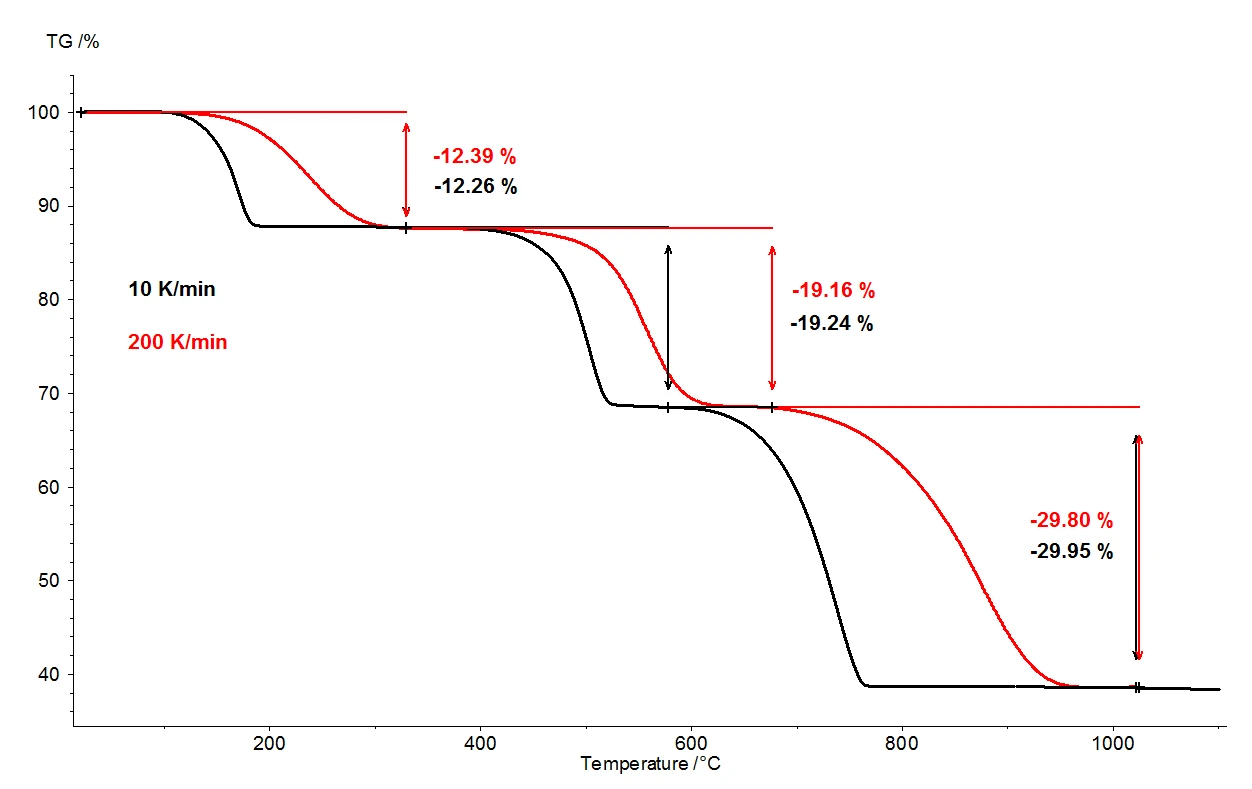
Heizt man Calciumoxalat-Monohydrat bis 1100 °C auf, so sind mit der Thermowaage drei sehr gut voneinander getrennte Massenverluststufen detektierbar. Abbildung 2 zeigt den Vergleich der thermogravimetrischen Ergebnisse zweier Messungen an Calciumoxalat-Monohydrat- Proben. Dabei sind die relativen Massenänderungen der Proben über der Temperatur aufgetragen. In Abbildung 3 ist der analoge temperaturabhängige Vergleich der beiden Messungen für die jeweils erste Ableitung der thermogravimetrischen Ergebnisse (DTG) dargestellt.
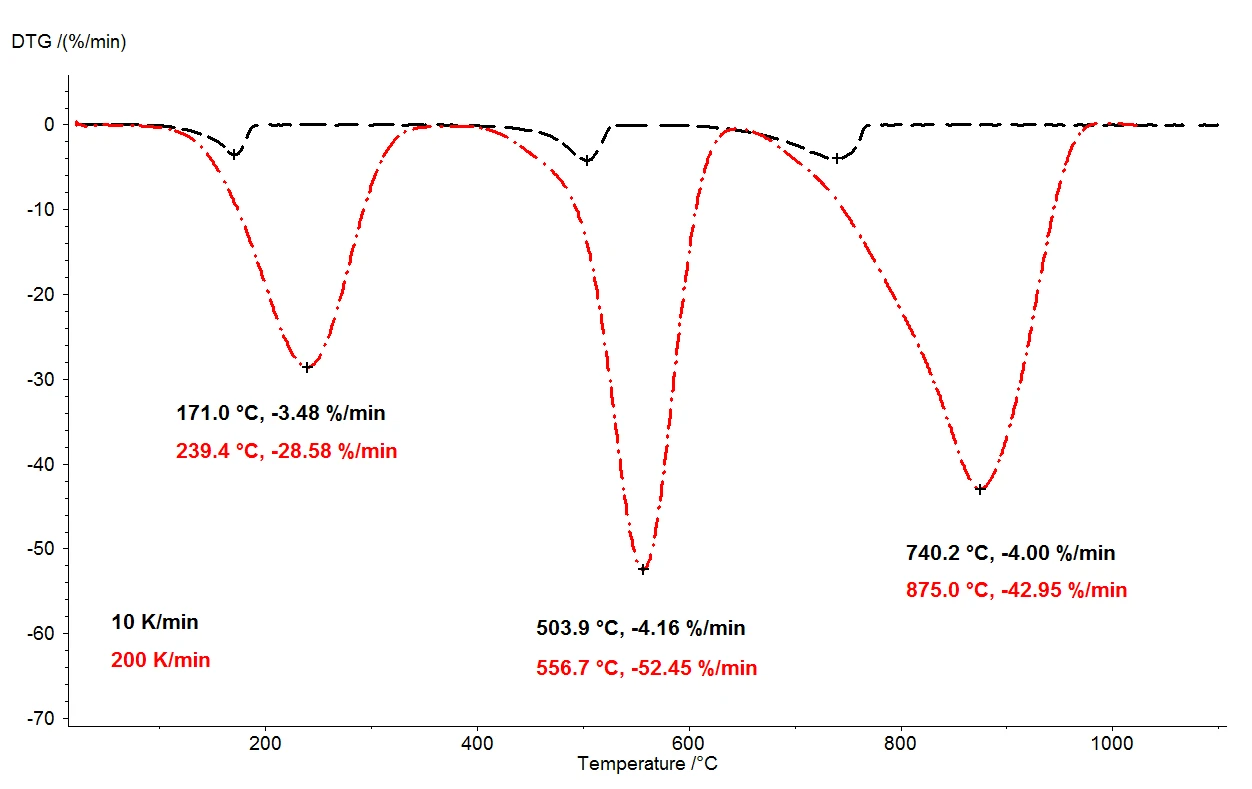
Bei ansonsten identischen Bedingungen wurden zwei verschiedene Heizraten gewählt, 10 K/min (schwarze Kurve) und 200 K/min (rote Kurve). Mit steigender Heizrate verschieben sich die Temperaturen der Massenverluststufen zu höheren Werten und die Freisetzungsraten, also die Geschwindigkeiten der Gasfreisetzungen, verzehnfachen sich in etwa (DTG-Minima, Abbildung 3). Die Temperaturverschiebung mit Variation der Aufheizraten ist gut bekannt und kann zur weiteren Auswertung von kinetischen Daten herangezogen werden [2]. Neben der Temperaturverschiebung ist wichtig festzuhalten, dass die Quantifizierung der Massenverluststufen von der Heizrate unabhängig ist. Damit steht die gesamte Information über den thermischen Abbau von Calciumoxalat-Monohydrat bei einer Aufheizrate von 200 K/min ebenso zur Verfügung wie bei der eher üblichen Aufheizrate von 10 K/min. Folglich geht bei der Variation der Heizrate prinzipiell keine Information verloren. Wenn man jedoch berücksichtigt, dass die Messung mit 10 K/min in einem Temperaturbereich zwischen Raumtemperatur und 1100 °C nahezu zwei Stunden in Anspruch nimmt und die Messung mit 200 K/min bereits in fünf Minuten beendet ist, resultiert eine enorme Zeitersparnis bei gleichem Informationsgehalt.
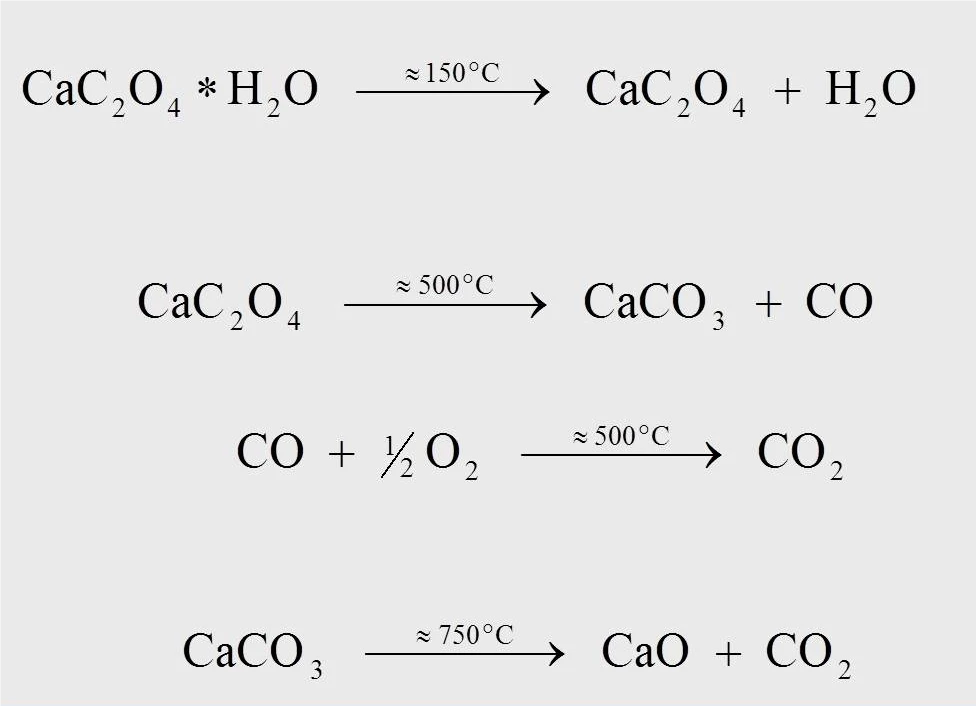
Die Reaktionsgleichungen für die thermische Abbaureaktion von Calciumoxalat-Monohydrat sind in Abbildung 4 gezeigt. Bei etwa 170 °C, bezogen auf die Messung mit 10 K/min, wird unter Abspaltung von Wasser aus dem Monohydrat das wasserfreie Calciumoxalat gebildet (1). Bei etwa 500 °C wandelt sich Calciumoxalat in Calciumcarbonat (CaCO3) um und Kohlenmonoxid (CO) wird abgespalten (2). Die Folgereaktion, bei der das freigesetzte Kohlenmonoxid zu Kohlendioxid (CO2) oxidiert wird (3), kann nur in einem sauerfstoffhaltigen Spülgasstrom stattfinden (z.B. synthetische Luft oder Sauerstoff). Bei einer Temperatur von 750 °C zersetzt sich Calciumcarbonat in Calciumoxid unter Abgabe von CO2 (4).