مقدمة
الأوكزالات هي أملاح حمض الأكساليك C2H2H2O4 (COOH)2 (حمض الإيثانيداروكربوكسيليك). يتبلور ملح الكالسيوم لحمض الأكساليك، أكسالات الكالسيوم، في صورة لا مائية وفي صورة مذاب مع جزيء واحد من الماء في الصيغة الواحدة، كأكسالات الكالسيوم أحادي الهيدرات CaC2O4*H2O.
الحدوث والتطبيق
على الرغم من أن أكسالات الكالسيوم أحادي الهيدرات هو ملح الأكسالات العضوية، إلا أنه يمكن العثور عليه في الطبيعة كمعدن أولي. يُظهر الشكل 1 بلورة ويوليت من منطقة شليما في سلسلة جبال إرتسغيبيرج الألمانية. وبالإضافة إلى ويويليت، يُعرف الويدلايت أيضًا كنوع معدني ثانٍ [1].

أكسالات الكالسيوم هي أيضًا المكون الرئيسي لحصوات الكلى.
في التحليل الحراري، يُستخدم مونوهيدرات أكسالات الكالسيوم الأحادي الهيدرات للتحقق من وظائف الموازين الحرارية. تتمتع هذه المادة بثبات جيد في التخزين؛ فهي لا تخضع للتغيير بمرور الوقت، وليس لديها أي ميل لامتصاص الرطوبة من جو المختبر. هذه الميزات تجعلها مادة مرجعية مثالية للاستخدام في فحص وظيفة قاعدة درجة الحرارة للميزان الحراري.
شروط القياس
- الآلة
- TG 209 F1 الميزان 209
- العينة
- CaC2O4*H2O
- أوزان العينة
- 8.43 مجم (المنحنى الأسود في الشكل 2) و
- 8.67 مجم (المنحنى الأحمر في الشكل 2)
- البوتقة
- Al2O3
- الغلاف الجوي
- النيتروجين
- معدل تدفق الغاز
- 40 مل/دقيقة
- معدل التسخين
- 10 كلفن/دقيقة (المنحنى الأسود في الشكل 2) و
- 200 كلفن/دقيقة (المنحنى الأحمر في الشكل 2)
قياس الجاذبية الحرارية
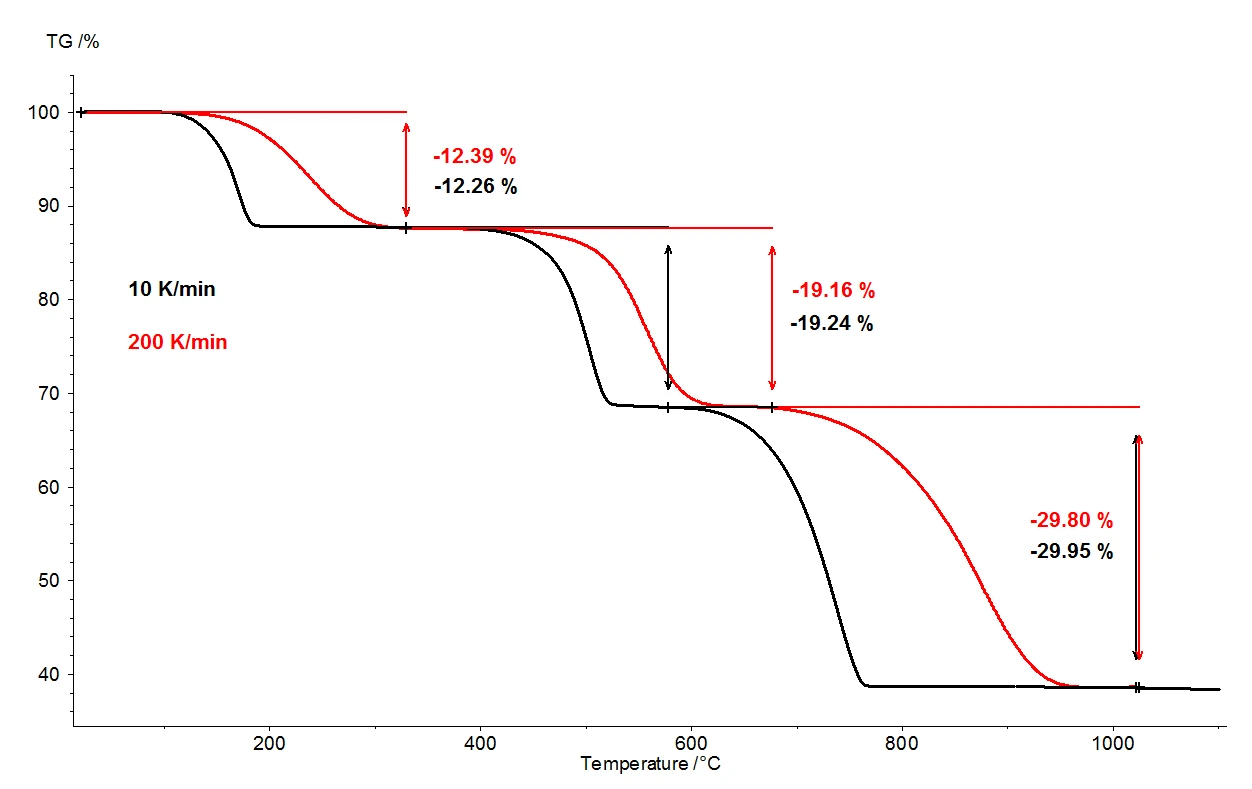
عندما يتم تسخين مونوهيدرات أكسالات الكالسيوم أحادي الهيدرات إلى 1100 درجة مئوية، يمكن الكشف عن ثلاث خطوات منفصلة بوضوح لفقدان الكتلة عن طريق الميزان الحراري. ويوضح الشكل 2 مقارنة بين نتائج قياس الثقل الحراري لقياسين على عينات مونوهيدرات أكسالات الكالسيوم الأحادية. يتم تسجيل تغيرات الكتلة النسبية للعينات على درجة الحرارة. وترد في الشكل 3 مقارنة مماثلة بين القياسين، كدالة لدرجة الحرارة، للمشتق الأول لنتائج قياس الثقل الحراري (DTG).
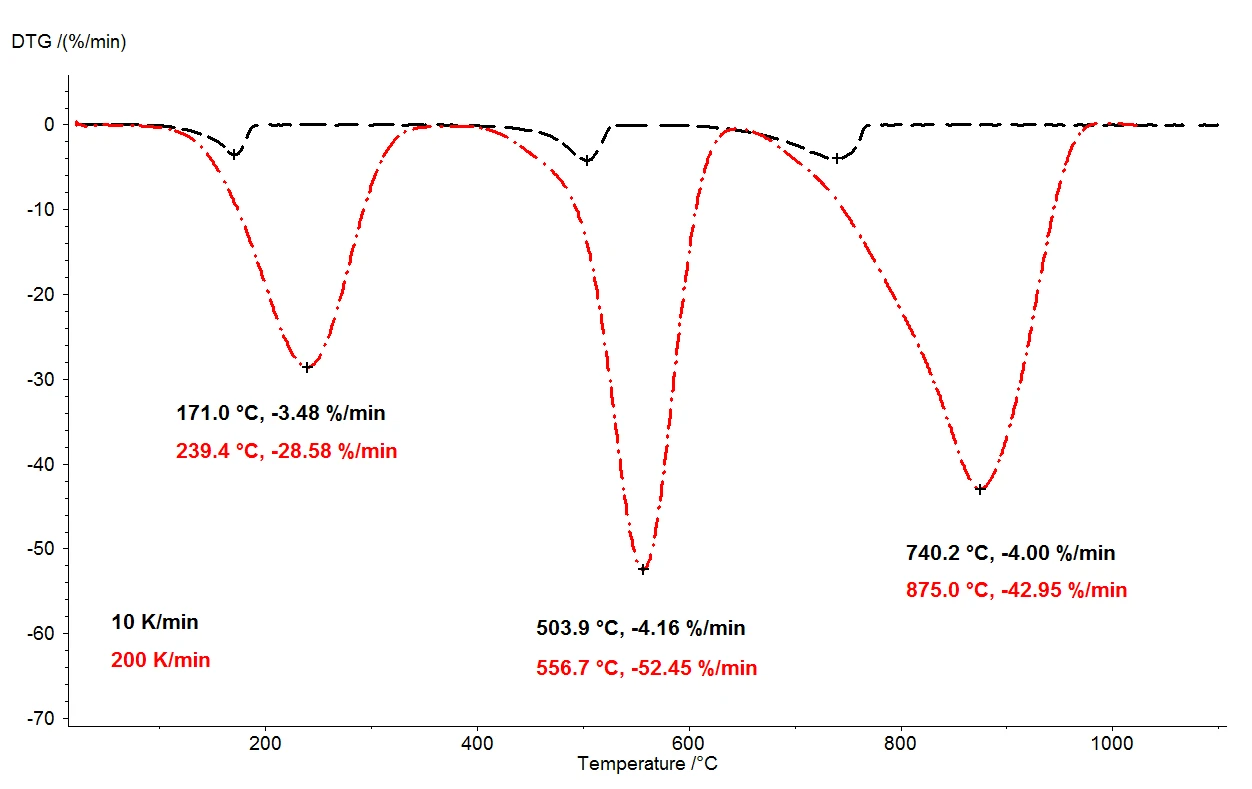
في ظل ظروف متطابقة، تم اختيار معدلي تسخين مختلفين: 10 كلفن/الدقيقة (المنحنى الأسود) و200 كلفن/الدقيقة (المنحنى الأحمر). مع زيادة معدل التسخين، تنزاح درجات حرارة خطوات فقدان الكتلة إلى قيم أعلى وتزداد معدلات الإطلاق - سرعة إطلاق الغاز - إلى عشرة أضعاف تقريبًا (الحد الأدنى DTG، الشكل 3). ويُعد التحول في درجة الحرارة الذي يحدث عند تغير معدل التسخين أمرًا مفهومًا جيدًا يمكن تطبيقه من أجل إجراء مزيد من التقييم للبيانات الحركية [2]. وإلى جانب الانزياح في درجة الحرارة، من المهم أيضًا ملاحظة أن القياس الكمي لخطوات فقدان الكتلة مستقل عن معدل التسخين. وبالتالي، يوفر معدل التسخين 200 كلفن/الدقيقة نفس المعلومات المتعلقة بالتحلل الحراري لأحادي هيدرات أكسالات الكالسيوم بمعدل التسخين الأكثر شيوعًا البالغ 10 كلفن/الدقيقة؛ ولا تضيع أي معلومات من خلال تسريع معدل التسخين. ومع ذلك، بينما ينتج عن معدل التسخين الأسرع نفس محتوى المعلومات، فإن معدل التسخين الأسرع يؤدي إلى توفير وقت هائل: يستغرق القياس عند 10 كلفن/الدقيقة ساعتين تقريبًا لتغطية نطاق درجة الحرارة من درجة حرارة الغرفة إلى 1100 درجة مئوية، ولكن القياس نفسه عند 200 كلفن/الدقيقة يكتمل بالفعل في خمس دقائق.
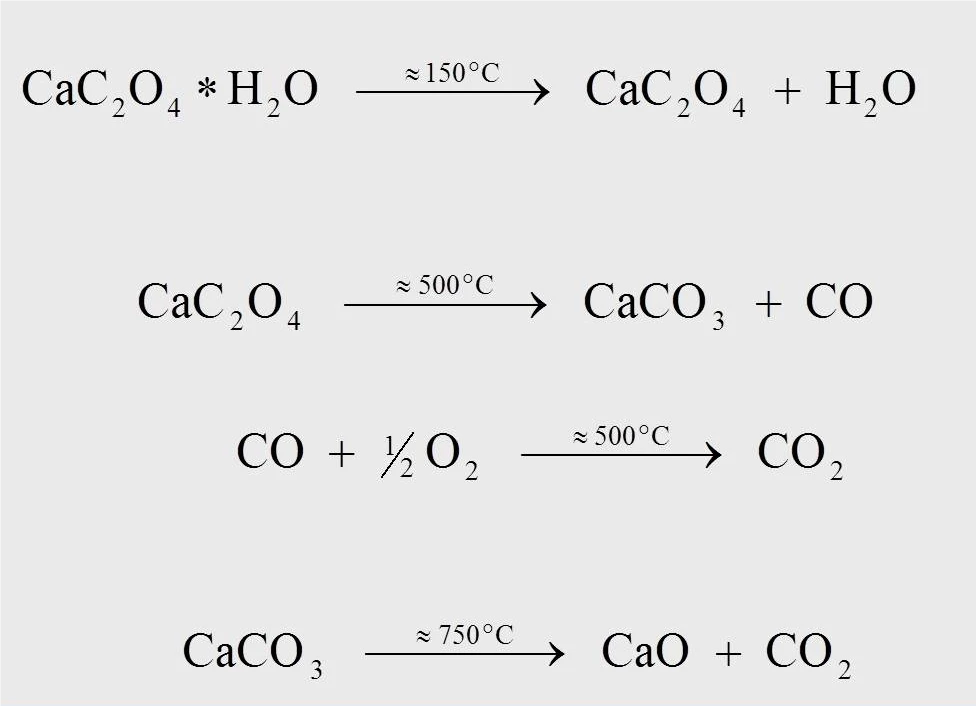
يوضح الشكل 4 معادلات التفاعل لتفاعل التحلل الحراري لمونوهيدرات أكسالات الكالسيوم أحادي الهيدرات. عند درجة حرارة 170 درجة مئوية تقريبًا، بالنسبة للقياس عند 10 كلفن/دقيقة، يتكون أكسالات الكالسيوم اللامائية عندما ينفصل الماء عن أحادي الهيدرات (1). وعند درجة حرارة 500 درجة مئوية تقريبًا، يتحول أكسالات الكالسيوم إلى كربونات الكالسيوم (CaCO3)، وينفصل أول أكسيد الكربون (CO) (2). لا يمكن أن يحدث التفاعل اللاحق، حيث يتأكسد أول أكسيد الكربون المنطلق إلى ثاني أكسيد الكربون (CO2) (3)، إلا في تدفق غاز تطهير يحتوي على الأكسجين (على سبيل المثال، الهواء الصناعي أو الأكسجين). وعند درجة حرارة 750 درجة مئوية، تتحلل كربونات الكالسيوم إلى أكسيد الكالسيوم مع إطلاق ثاني أكسيد الكربون (4).