Wprowadzenie
Szczawiany są solami kwasu szczawiowego C2H2O4 (COOH)2 (kwas etanodikarboksylowy). Sól wapniowa kwasu szczawiowego, szczawian wapnia, krystalizuje w postaci bezwodnej i jako rozpuszczalnik z jedną cząsteczką wody na wzór, jako monohydrat szczawianu wapnia CaC2O4*H2O.
Występowanie i zastosowanie
Chociaż monohydrat szczawianu wapnia jest solą organicznego kwasu, można go znaleźć w naturze jako minerał pierwotny. Rysunek 1 przedstawia kryształ Whewellite z lokalizacji Schlema w niemieckim paśmie górskim Erzgebirge. Oprócz Whewellite, weddellite jest również znany jako drugi gatunek minerału [1].

Szczawian wapnia jest również głównym składnikiem kamieni nerkowych.
W analizie termicznej monohydrat szczawianu wapnia jest wykorzystywany do sprawdzania funkcjonalności termobalansów. Substancja ta charakteryzuje się dobrą stabilnością podczas przechowywania; nie podlega zmianom w czasie, ani nie ma tendencji do adsorbowania wilgoci z atmosfery laboratoryjnej. Cechy te sprawiają, że jest to idealna substancja referencyjna do sprawdzania funkcjonalności termobalansu w oparciu o temperaturę.
Warunki pomiaru
- Instrument
- TG 209 F1 Libra®
- Próbka
- CaC2O4*H2O
- Masa próbki
- 8.43 mg (czarna krzywa na rysunku 2) i
- 8.67 mg (czerwona krzywa na rysunku 2)
- Tygiel
- Al2O3
- Atmosfera
- Azot
- Natężenie przepływu gazu
- 40 ml/min
- Szybkość ogrzewania
- 10 K/min (czarna krzywa na rysunku 2) i
- 200 K/min (czerwona krzywa na rysunku 2)
Termograwimetria
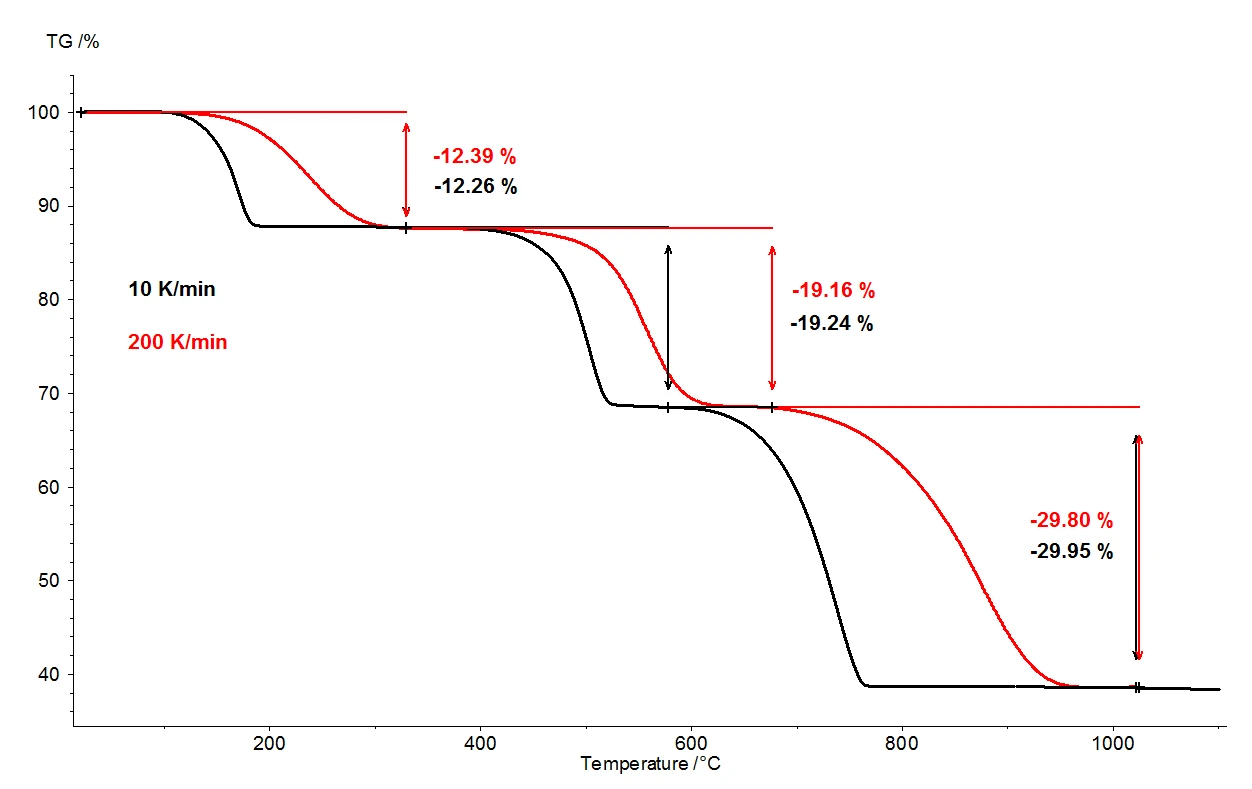
Gdy monohydrat szczawianu wapnia jest podgrzewany do 1100°C, za pomocą termowagi można wykryć trzy wyraźnie oddzielone etapy utraty masy. Rysunek 2 przedstawia porównanie wyników termograwimetrycznych dwóch pomiarów próbek monohydratu szczawianu wapnia. Względne zmiany masy próbek są rejestrowane w zależności od temperatury. Na rysunku 3 przedstawiono analogiczne porównanie dwóch pomiarów, w funkcji temperatury, dla pierwszej pochodnej wyników termograwimetrycznych (DTG).
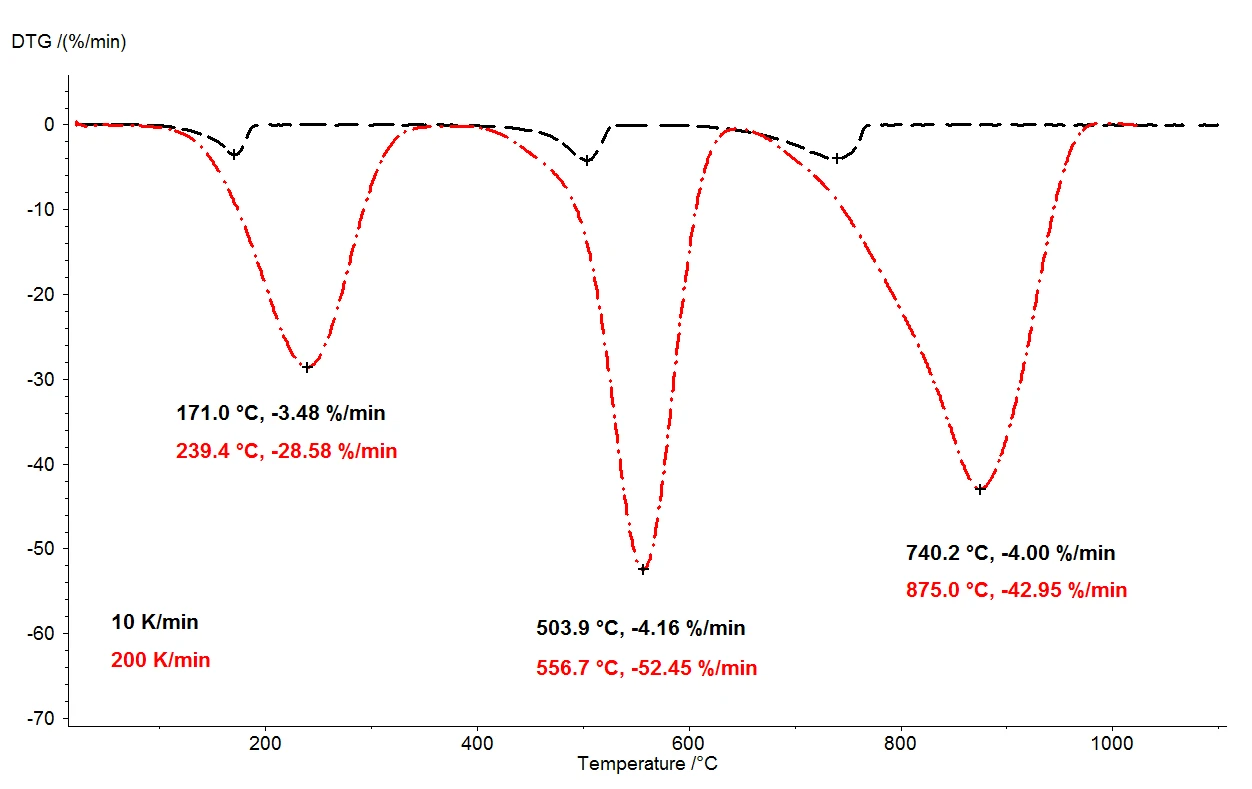
selectW identycznych warunkach zastosowano dwie różne szybkości ogrzewania: 10 K/min (czarna krzywa) i 200 K/min (czerwona krzywa). Wraz ze wzrostem szybkości ogrzewania, temperatury etapów utraty masy są przesunięte do wyższych wartości, a szybkość uwalniania - szybkość uwalniania gazu - wzrasta około dziesięciokrotnie (minima DTG, rysunek 3). Przesunięcie temperatury, które ma miejsce przy zmianie szybkości ogrzewania, jest dobrze poznanym zjawiskiem, które można zastosować do dalszej oceny danych kinetycznych [2]. Oprócz zmiany temperatury, ważne jest również, aby zauważyć, że kwantyfikacja etapów utraty masy jest niezależna od szybkości ogrzewania. Szybkość ogrzewania 200 K/min dostarcza zatem tych samych informacji dotyczących degradacji termicznej monohydratu szczawianu wapnia, co bardziej typowa szybkość ogrzewania 10 K/min; przyspieszenie ogrzewania nie powoduje utraty informacji. Przynosząc taką samą zawartość informacji, szybsze tempo ogrzewania skutkuje jednak ogromną oszczędnością czasu: pomiar przy 10 K/min zajmuje prawie dwie godziny, aby pokryć zakres temperatur od temperatury pokojowej do 1100°C, ale ten sam pomiar przy 200 K/min jest zakończony już w pięć minut.
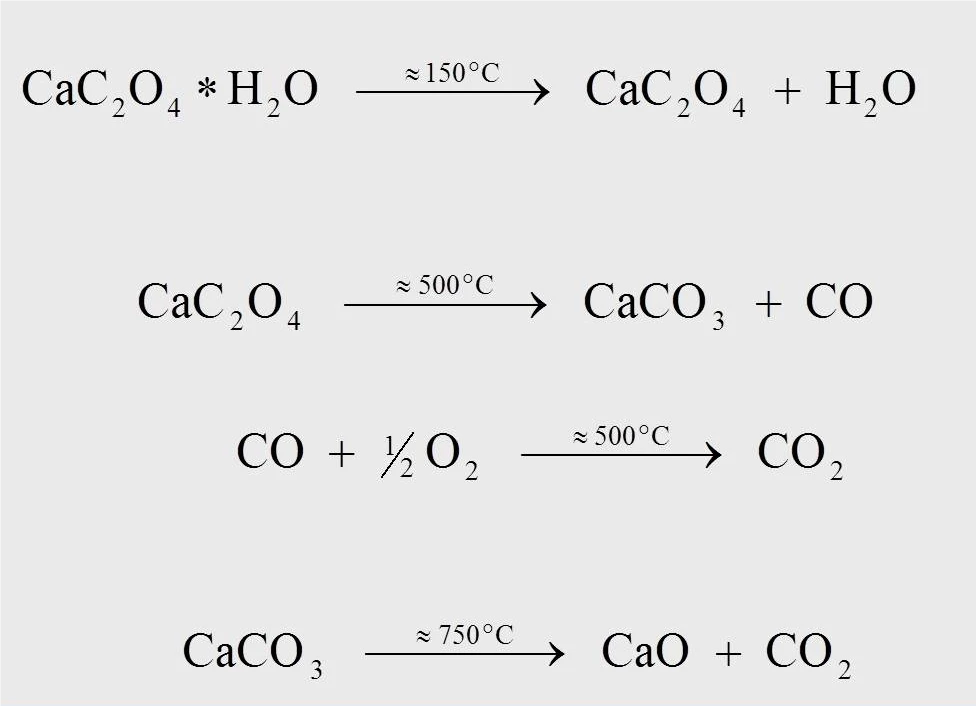
Równania reakcji rozkładu termicznego monohydratu szczawianu wapnia przedstawiono na rysunku 4. W temperaturze około 170°C, przy pomiarze z prędkością 10 K/min, bezwodny szczawian wapnia powstaje, gdy woda oddziela się od monohydratu (1). W temperaturze około 500°C szczawian wapnia przekształca się w węglan wapnia (CaCO3), a tlenek węgla (CO) oddziela się (2). Kolejna reakcja, w której uwolniony tlenek węgla jest utleniany do dwutlenku węgla (CO2) (3), może zachodzić tylko w strumieniu gazu oczyszczającego zawierającego tlen (np. syntetycznego powietrza lub tlenu). W temperaturze 750°C węglan wapnia rozkłada się do tlenku wapnia z uwolnieniemCO2 (4).