Pochodzenie i zastosowanie
Łupek mikowy jest wydobywany od czasów prehistorycznych. Mika była stosowana w szybach okiennych przed przemysłową produkcją szkła, ponieważ jej warstwowa struktura pozwala na łatwe rozbicie na cienkie arkusze. Obecnie mika jest stosowana jako pigment w farbach i kosmetykach. Ze względu na dobre przewodnictwo cieplne i właściwości izolacji elektrycznej, innym ważnym obszarem zastosowań miki jest przemysł elektroniczny, gdzie jest ona wykorzystywana jako dyski izolacyjne do elementów półprzewodnikowych lub jako dielektryk do kondensatorów o bardzo niskich stratach [1].
Struktura
Mika to ogólny termin określający grupę minerałów należących do krzemianów blaszkowych. Ich ogólny skład chemiczny to DG2.3 [T4O10]X2. Jedna warstwa składa się z połączonych narożnikami czworościanów SiO2 (dla T = Si); inna warstwa składa się z ośmiościanów GO6. Każda warstwa oktaedru jest osadzona pomiędzy dwiema warstwami tetraedru. Ta sekwencja warstw T-O-T (tetraedr-oktaedr-tetraedr) nie jest jednak neutralna pod względem ładunku. Wyrównanie ładunku uzyskuje się za pomocą mostkujących anionów międzywarstwowych (X) [2].

Warunki pomiaru
- Instrument
- TG 209 F1 Libra®
- Próbka
- Mika
- Masa próbki
- 5.106 mg
- Tygiel
- Al2O3
- Atmosfera
- Azot
- Natężenie przepływu gazu
- 40 ml/min
- Szybkość ogrzewania
- 10 K/min
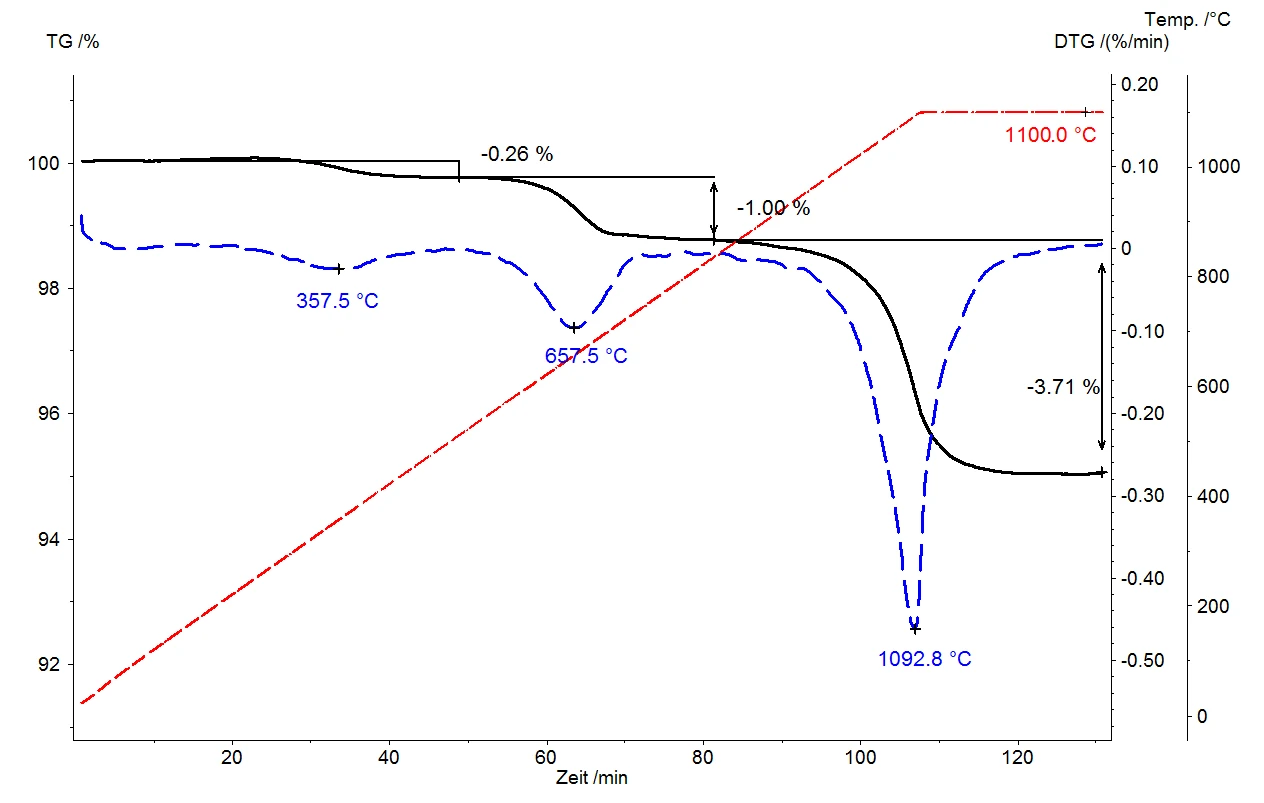
Termograwimetria
Termowaga może zapewnić doskonałą charakterystykę zachowania termicznego substancji nieorganicznych. W sposób ciągły rejestruje wszelkie zmiany w składzie próbki, podczas gdy zastosowanie dynamicznej szybkości ogrzewania (10 K/min w naszym przykładzie) dodatkowo pozwala na ocenę występowania próbek w funkcji temperatury. Ponieważ szybkość ogrzewania jest miarą energii dostarczanej do próbki, pozwala to na wyciągnięcie wniosków dotyczących wymaganej energii uwalniania i/lub energii wiązania uwalnianych substancji.
Przedstawiony tutaj przykład z próbką miki pokazuje trzy dobrze rozdzielone etapy utraty masy; jeden w 357°C, drugi w 657°C i trzeci w 1092°C. Dobre rozdzielenie tych etapów utraty masy pozwala na łatwe ilościowe określenie ilości gazu uwolnionego z próbek poprzez ocenę etapów w różnych temperaturach. Względne zmiany masy wynoszą 0,26%, 1,00% i 3,71%. Temperatura uwalniania jest wskaźnikiem siły adsorpcji lub wiązania: im wyższa jej wartość, tym silniejsza adsorpcja gazu na powierzchni kryształu lub wiązanie ze strukturą kryształu przed uwolnieniem. W przeciwieństwie do "pirolizy błyskawicznej" - gdzie próbka jest podgrzewana do maksymalnej temperatury w ciągu kilku sekund, a wszystkie gazy są uwalniane bardzo gwałtownie - bardzo zmienne szybkości ogrzewania termograwimetrii oraz połączenie segmentów dynamicznych i izotermicznych pozwalają na uwalnianie gazowych produktów rozkładu w funkcji temperatury, a zatem w sposób stopniowy. Nasz przykład z miką dodatkowo pokazuje, że ogrzewanie próbki do 1100°C z prędkością 10 K/min nie było wystarczające, aby umożliwić zakończenie pełnej reakcji rozkładu, a zatem oczywiście nie było również wystarczające do jej kwantyfikacji.
W rzeczywistości do całkowitego zakończenia reakcji konieczna była kolejna faza izotermiczna trwająca 30 minut. Taka elastyczność w kontroli temperatury nie tylko ułatwia kwantyfikację, ale dodatkowo pozwala na identyfikację gazów wydzielających się z próbki podczas procesu termograwimetrycznego. Dobrze nadaje się do tego technika zwana "sprzężeniem", w której termoanalityczne przyrządy pomiarowe są sprzężone z przyrządami do metod spektroskopowych, takich jak spektrometria masowa lub spektroskopia FT-IR.