Введение
Оксалаты - это соли щавелевой кислоты C2H2O4 (COOH)2 (этандикарбоновая кислота). Кальциевая соль щавелевой кислоты, оксалат кальция, кристаллизуется в безводной форме и в виде сольвата с одной молекулой воды на формулу, как моногидрат оксалата кальция CaC2O4*H2O.
Возникновение и применение
Хотя моногидрат оксалата кальция является солью органических соединений, в природе он встречается как первичный минерал. На рисунке 1 показан кристалл вевеллита из местности Шлема в горном массиве Эрцгебирге в Германии. Помимо вевеллита, в качестве второго минерального вида известен также клинделлит [1].

Оксалат кальция также является основным компонентом камней в почках.
В термическом анализе моногидрат оксалата кальция используется для проверки работоспособности термобаллонов. Это вещество обладает хорошей стабильностью при хранении: оно не изменяется с течением времени и не склонно адсорбировать влагу из лабораторной атмосферы. Эти свойства делают его идеальным референтным веществом для использования при проверке функциональности термобаллонов.
Условия измерения
- Инструмент
- TG 209 F1 Libra®
- Образец
- CaC2O4*H2O
- Масса образца
- 8.43 мг (черная кривая на рисунке 2) и
- 8.67 мг (красная кривая на рис. 2)
- Тигель
- Al2O3
- Атмосфера
- Азот
- Скорость потока газа
- 40 мл/мин
- Скорость нагрева
- 10 К/мин (черная кривая на рис. 2) и
- 200 К/мин (красная кривая на рисунке 2)
Термогравиметрия
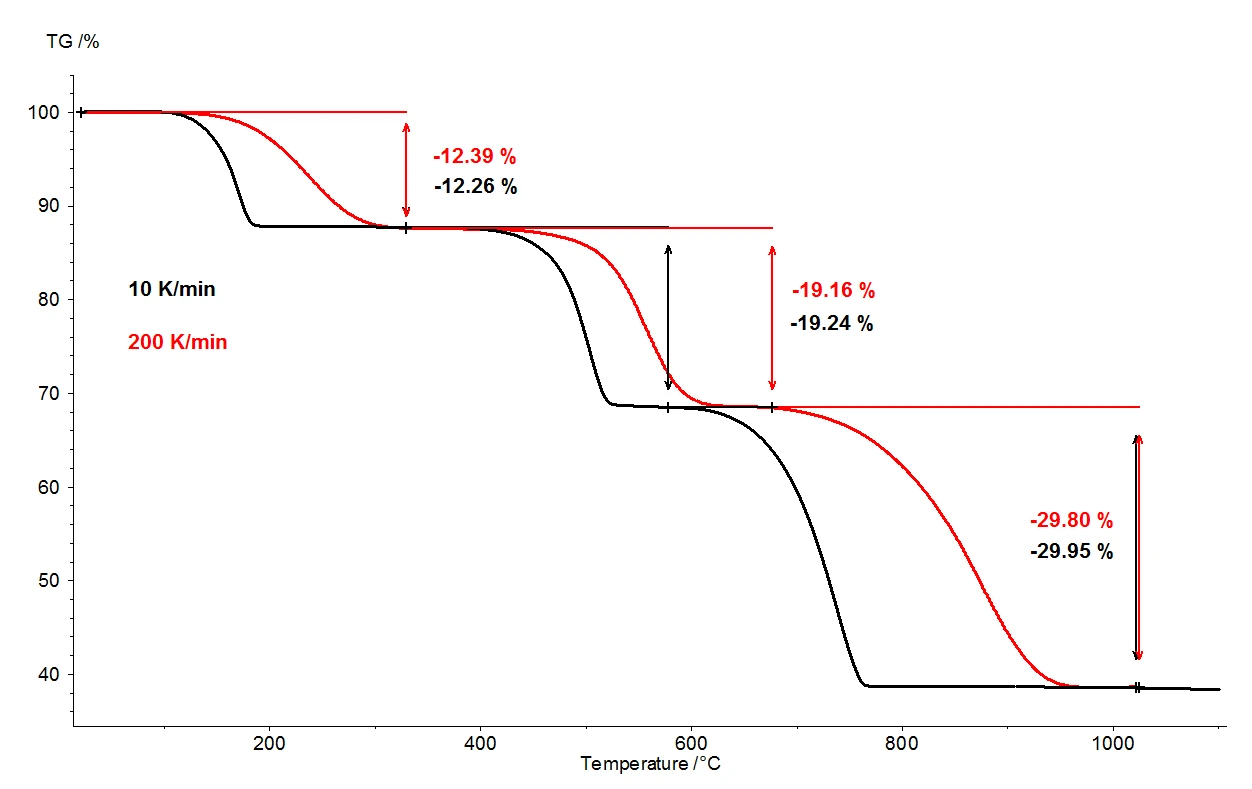
При нагревании моногидрата оксалата кальция до 1100°C с помощью термовесов можно обнаружить три четко разделенных этапа потери массы. На рис. 2 показано сравнение результатов термогравиметрии двух измерений образцов моногидрата оксалата кальция. Относительные изменения массы образцов регистрируются в зависимости от температуры. На рисунке 3 представлено аналогичное сравнение двух измерений в зависимости от температуры для первой производной результатов термогравиметрии (DTG).
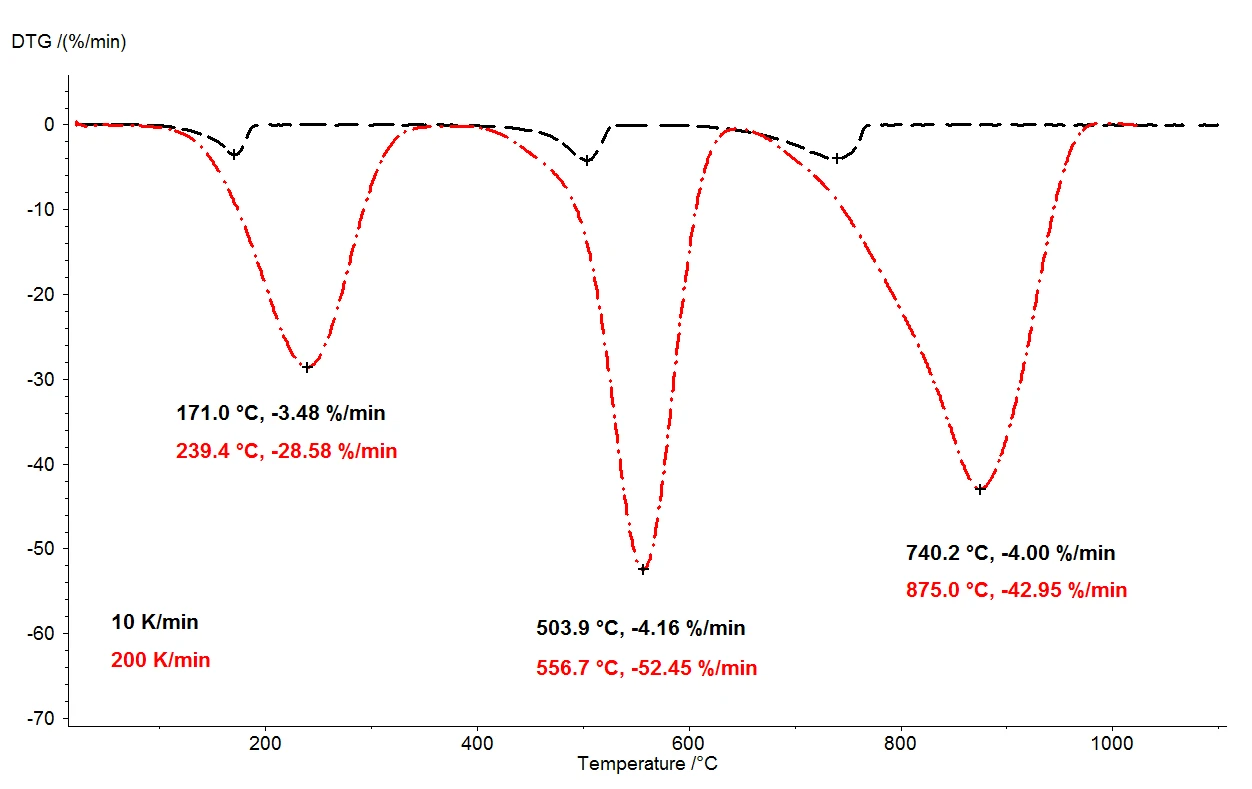
selectПри одинаковых условиях были использованы две различные скорости нагрева: 10 К/мин (черная кривая) и 200 К/мин (красная кривая). При увеличении скорости нагрева температуры ступеней потери массы сдвигаются к более высоким значениям, а скорости выделения - скорость выделения газа - увеличиваются примерно в десять раз (минимумы DTG, рис. 3). Сдвиг температуры, происходящий при изменении скорости нагрева, является хорошо изученным явлением, которое может быть использовано для дальнейшей оценки кинетических данных [2]. Помимо температурного сдвига, важно отметить, что количественная оценка этапов потери массы не зависит от скорости нагрева. Таким образом, скорость нагрева 200 К/мин предоставляет всю ту же информацию о термической деградации моногидрата оксалата кальция, что и более обычная скорость нагрева 10 К/мин; при ускорении скорости нагрева информация не теряется. Однако при той же информативности более высокая скорость нагрева позволяет значительно сэкономить время: измерение при 10 К/мин занимает почти два часа для охвата температурного диапазона от комнатной температуры до 1100°C, а то же самое измерение при 200 К/мин выполняется уже за пять минут.
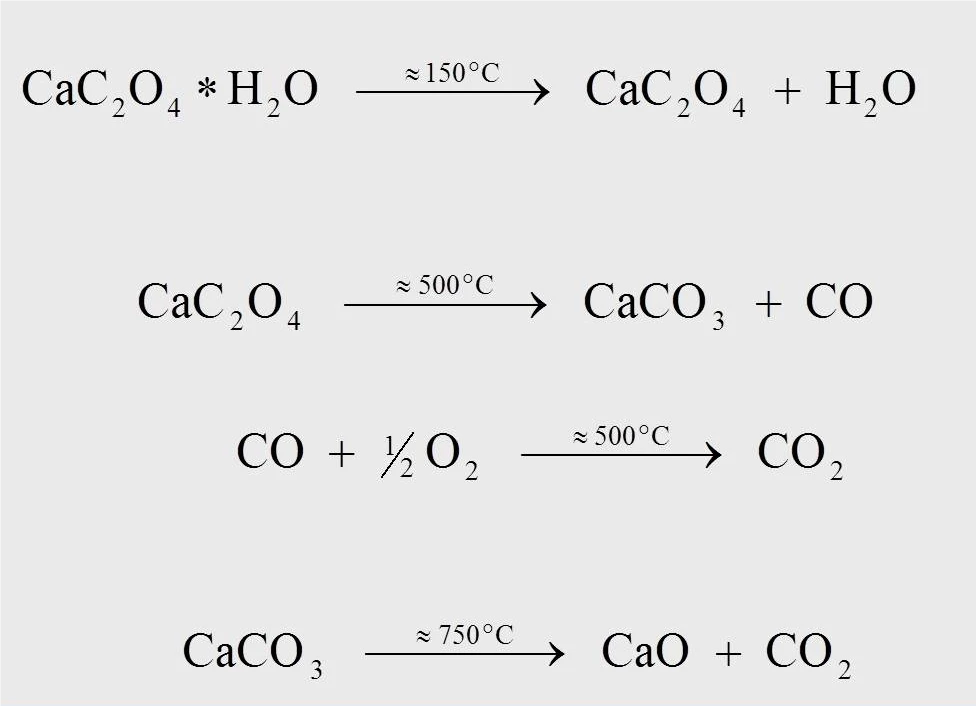
Реакционные уравнения для реакции термической деградации моногидрата оксалата кальция показаны на рисунке 4. Приблизительно при 170°C, для измерения при 10 К/мин, образуется безводный оксалат кальция, когда вода отделяется от моногидрата (1). При температуре около 500°C оксалат кальция превращается в карбонат кальция (CaCO3), а монооксид углерода (CO) отщепляется (2). Последующая реакция, в ходе которой высвободившийся монооксид углерода окисляется до диоксида углерода (CO2) (3), может происходить только в потоке кислородсодержащего продувочного газа (например, синтетического воздуха или кислорода). При температуре 750°C карбонат кальция разлагается на оксид кальция с выделениемCO2 (4).