Εισαγωγή

Ενώ αναλυτικές τεχνικές όπως η EDX ή το ICP-MS παρέχουν λεπτομερή ανάλυση των χημικών στοιχείων, π.χ. εκείνων που απαντούν σε ένα δείγμα άλατος [1], οι μέθοδοι θερμικής ανάλυσης μπορούν επίσης να χρησιμοποιηθούν για την ταυτοποίηση και τον χαρακτηρισμό των διαφόρων χημικών ενώσεων που υπάρχουν σε ένα τέτοιο δείγμα. Η ταυτόχρονη θερμική ανάλυση (STA), η οποία αναφέρεται στη θερμοβαρυμετρία (TGA) και τη διαφορική θερμιδομετρία σάρωσης (DSC) που εκτελούνται ταυτόχρονα σε ένα πείραμα, χρησιμοποιήθηκε, για παράδειγμα, για τη διερεύνηση των πρώτων υλών τσιμέντου, συμπεριλαμβανομένης της παρουσίας και της επίδρασης των προσμίξεων αλάτων αλκαλικών μετάλλων [2]. Ένα άλλο παράδειγμα είναι η διαδικασία τήξης και η ειδική θερμοχωρητικότητα του υλικού αλλαγής φάσης (PCM) του νιτρικού νατρίου, NaNO3, η οποία μελετήθηκε μέσω DSC [3].
Η παρούσα εργασία ασχολείται με μετρήσεις STA σε NaCl, KCl, το συνηθισμένο επιτραπέζιο αλάτι και το λεγόμενο αλάτι Ιμαλαΐων, όπου η τήξη, η μερική εξάτμιση και η ανάλυση της σύστασης των αλάτων βρίσκονται στο επίκεντρο. Τα αλκαλικά άλατα, όπως το NaCl (αλάτι) και το KCl (σιλβίτης), παίζουν σημαντικό ρόλο στην καθημερινή μας ζωή. Ενώ το NaCl είναι το κύριο συστατικό του επιτραπέζιου ή μαγειρικού αλατιού, το KCl μπορεί, για παράδειγμα, να χρησιμοποιηθεί ως αλάτι δρόμου το χειμώνα. Το αλάτι των Ιμαλαΐων που προέρχεται από το Πακιστάν είναι ένα φυσικό αλάτι που περιέχει -μαζί με το NaCl- διάφορα μέταλλα και οξείδια όπως το Fe2O3 [1], το οποίο είναι υπεύθυνο για το ελαφρώς ροζ χρώμα του (βλ. παραπάνω φωτογραφία).
Πειραματικό
Οι μετρήσεις πραγματοποιήθηκαν με τη χρήση του STA 449 F5 Jupiter® (βλέπε σχήμα 1). Αυτό το όργανο, το οποίο διαθέτει κλίβανο SiC που επιτρέπει μέγιστη θερμοκρασία δείγματος 1600 °C, μπορεί να εξοπλιστεί προαιρετικά με τον αυτόματο μετατροπέα δείγματος (ASC) και τεχνικές σύζευξης για ανάλυση εξελιγμένων αερίων, όπως MS, FT-IR ή GC-MS. Το εύρος ζύγισης του ζυγού είναι τόσο μεγάλο όσο και 35 g με ανάλυση ζυγού 0,1 μg σε όλο το εύρος. Ένα άλλο πλεονέκτημα του STA 449 F5 Jupiter® είναι η λειτουργικότητα του λογισμικού TG-BeFlat® που λαμβάνει αυτόματα υπόψη το φαινόμενο της άνωσης, ώστε να μην είναι πλέον απαραίτητες οι μετρήσεις βασικής γραμμής για τις τυποποιημένες δοκιμές.

Οι συνθήκες μέτρησης που εφαρμόστηκαν για την παρούσα εργασία συνοψίζονται στον πίνακα 1.
Πίνακας 1: Συνθήκες μέτρησης που εφαρμόζονται στην παρούσα εργασία
Συνθήκες μέτρησης | |
|---|---|
| Όργανο | STA 449 F5 Jupiter® |
| Φορέας δείγματος | TGA-DSC τύπου S |
| Χωνευτήρια | PtRh (0,19 ml) |
| Ρυθμός θέρμανσης | 10 K/min |
| Μάζες δείγματος | 23 ± 1 mg |
| Ατµόσφαιρα | N2 |
| Ροή αερίου καθαρισμού | 70 ml/min |
Τα δείγματα NaCl [4] και KCl [5] είχαν ονομαστική καθαρότητα 99,8%, ενώ δεν υπήρχαν πληροφορίες σχετικά με την καθαρότητα για το επιτραπέζιο αλάτι και το αλάτι Ιμαλαΐων. Όλα τα δείγματα μετρήθηκαν ως λεπτό στρώμα κόκκων που μόλις κάλυπτε τον πυθμένα του χωνευτηρίου- το υλικό του δείγματος δεν αλέστηκε ούτε συμπιέστηκε.
Αποτελέσματα και συζήτηση
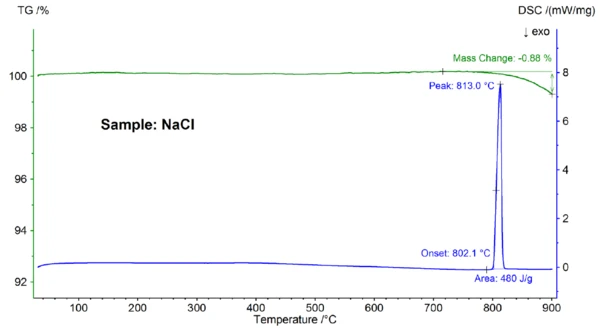
Στο σχήμα 2 απεικονίζεται η εξαρτώμενη από τη θερμοκρασία μεταβολή μάζας και ο ρυθμός ροής θερμότητας του δείγματος NaCl. Σε μια προεκτιμώμενη θερμοκρασία έναρξης 802,1 °C παρατηρήθηκε ένα ενδόθερμο φαινόμενο με μέγιστη θερμοκρασία 813 °C και ενθαλπία 480 J/g, το οποίο μπορεί να αποδοθεί στην τήξη του δείγματος. Η θερμοκρασία έναρξης, η οποία αντικατοπτρίζει το σημείο τήξης, ταιριάζει καλά με τη βιβλιογραφική τιμή των 801°C- η ενθαλπία των 480 J/g είναι επίσης σε καλή συμφωνία με την τιμή της θερμότητας τήξης των 484 J/g που βρέθηκε στη βιβλιογραφία [6]. Πάνω από τους 800°C περίπου, σημειώθηκε απώλεια μάζας 0,9%, η οποία οφείλεται σε μερική εξάτμιση του δείγματος.
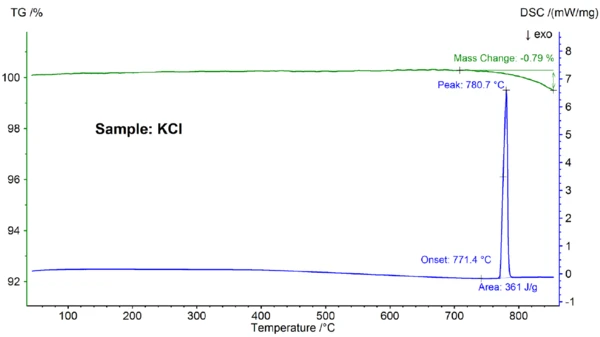
Τα αποτελέσματα STA για το δείγμα KCl παρουσιάζονται στο σχήμα 3. Παρατηρήθηκε και πάλι τήξη και μερική εξάτμιση- το σημείο τήξης, που ανιχνεύθηκε στους 771,4 °C, βρίσκεται σε καλή συμφωνία με τη βιβλιογραφική τιμή των 772 °C και η τιμή της ενθαλπίας 361 J/g είναι και πάλι σύμφωνη με την τιμή των 351 J/g που αναφέρεται στην αναφορά [6].
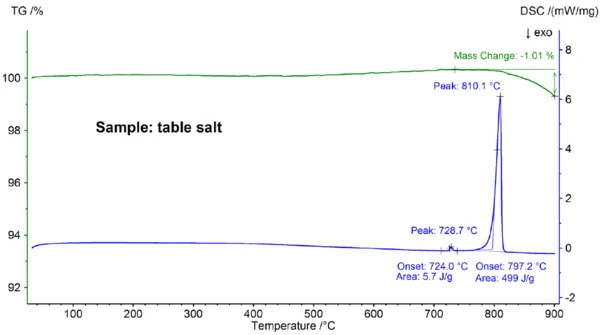
Στο σχήμα 4 παρουσιάζονται τα αποτελέσματα STA που προέκυψαν για το δείγμα επιτραπέζιου αλατιού, τα οποία διαφέρουν σαφώς από τα αποτελέσματα που προέκυψαν για το καθαρό δείγμα NaCl (συγκρίνετε τα σχήματα 4 και 2): Η έναρξη της κύριας κορυφής DSC είναι στους 797,2°C και συνεπώς σημαντικά χαμηλότερη από την τιμή των 802,1°C που παρατηρήθηκε για το καθαρό NaCl- επίσης, ανιχνεύθηκε ένα πρόσθετο ενδόθερμο φαινόμενο σε μια προεκτιμώμενη θερμοκρασία έναρξης 724°C. Η ενθαλπία του κύριου φαινομένου τήξης 499 J/g βρίσκεται στην ίδια περιοχή με την τιμή 480 J/g που παρατηρήθηκε για το καθαρό NaCl, ενώ η ενθαλπία του πρώτου φαινομένου είναι μόνο 6 J/g. Τα αποτελέσματα αυτά καταδεικνύουν ότι το επιτραπέζιο αλάτι δεν είναι - όπως αναμενόταν - καθαρό NaCl- η καμπύλη DSC που βρέθηκε για το δείγμα επιτραπέζιου αλατιού παρατηρείται συνήθως για δυαδικά μίγματα αλάτων [7]. Σε αυτή την περίπτωση, το NaI-NaCl με συγκέντρωση NaI στην κατώτερη ποσοστιαία περιοχή είναι ο πιθανότερος υποψήφιος [7].
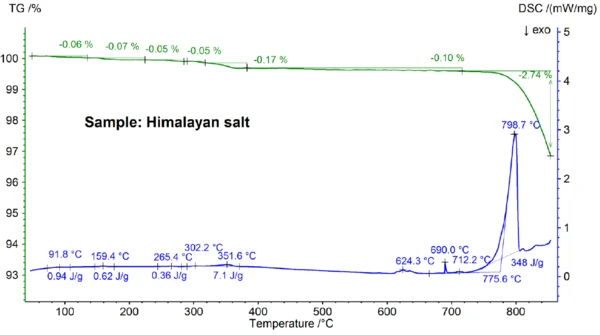
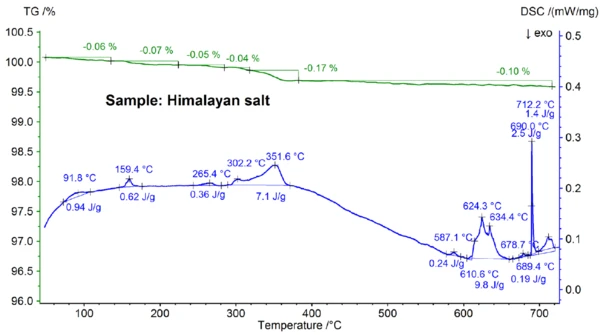
Τα αποτελέσματα STA που προέκυψαν για το αλάτι Ιμαλαΐων και παρουσιάζονται στα σχήματα 5α και 5β είναι ακόμη πιο πολύπλοκα από τα αποτελέσματα για το επιτραπέζιο αλάτι. Αυτό μπορεί ήδη να φανεί στα βήματα απώλειας μάζας 0,06%, 0,07%, 0,05%, 0,05%, 0,17% και 0,10% που παρατηρούνται κάτω από τους 700°C μόνο για το δείγμα αλατιού Ιμαλαΐων (βλέπε σχήμα 5β). Κάτω από τους 400°C περίπου, το σήμα DSC έδειξε ενδοθερμικά φαινόμενα που συσχετίζονται - και τα οποία οφείλονται στα βήματα απώλειας μάζας- λεπτομέρειες όπως οι θερμοκρασίες κορυφής και οι ενθαλπίες φαίνονται στο σχήμα 5β. Η απώλεια μάζας κάτω από τους 200°C περίπου οφείλεται πιθανότατα στην απελευθέρωση υγρασίας και στην αφυδάτωση του γύψου (μείγμα CaSO4∙2H2Oκαι CaSO4∙½H2O) με εκτιμώμενη συγκέντρωση στην περιοχή sub percent. Μεταξύ περίπου 200°C και 400°C, τα στάδια απώλειας μάζας θα μπορούσαν να οφείλονται στη διάσπαση διαφόρων ανθρακικών ενώ το στάδιο απώλειας μάζας στην περιοχή των 450°C θα μπορούσε να οφείλεται στην αφυδάτωση του Ca(OH)2. Για περαιτέρω ερμηνείες των βημάτων απώλειας μάζας, η ανάλυση των εξελιγμένων αερίων θα ήταν σαφώς χρήσιμη [8]. Το αποτέλεσμα της DSC σε θερμοκρασίες άνω των 580°C είναι επίσης πολύ περίπλοκο (βλέπε σχήμα 5β): Εντοπίστηκαν τουλάχιστον επτά ενδόθερμες επιδράσεις DSC. Η κύρια κορυφή στους 799°C οφείλεται και πάλι πιθανότατα σε ένα δυαδικό μίγμα πλούσιο σε NaCl, όπως NaI-NaCl, KCl-NaCl [7] ή Na2CO3- NaCl [7, 9], από όπου μπορεί επίσης να προέρχεται η κορυφή DSC στους 712°C. Οι υπόλοιπες επιδράσεις DSC μεταξύ 580°C και 720°C οφείλονται πιθανώς στις διαδικασίες τήξης διαφόρων ιωδιούχων, φθοριούχων, χλωριούχων, ανθρακικών ή θειικών αλάτων και μιγμάτων αυτών με NaCl ή KCl [7, 10]. Για παράδειγμα, η κορυφή DSC στους 587°C θα μπορούσε να οφείλεται σε CaI2 ή K2SO4, η απότομη κορυφή στους 690°C θα μπορούσε να οφείλεται σε KI και η κορυφή στους 679°C θα μπορούσε να οφείλεται σε δομικό μετασχηματισμό του Fe2O3 [10]. Περαιτέρω λεπτομέρειες, όπως οι θερμοκρασίες κορυφής και οι ενθαλπίες, φαίνονται και πάλι στο σχήμα 5β. Η απώλεια μάζας του αλατιού των Ιμαλαΐων 2,74% πάνω από τους 700°C (βλ. σχήμα 5α), η οποία οφείλεται και πάλι σε μερική εξάτμιση, είναι σημαντικά υψηλότερη από εκείνη των άλλων δειγμάτων που εξετάστηκαν.
Συμπέρασμα
Οι έρευνες σε NaCl, KCl, επιτραπέζιο αλάτι και αλάτι Ιμαλαΐων με τη βοήθεια του STA 449 F5 Jupiter® έδειξαν ότι το όργανο αυτό είναι κατάλληλο για τη μελέτη ουσιών όπως τα αλκαλικά άλατα και τα μείγματά τους. Ιδιαίτερα το σήμα DSC, το οποίο αντανακλά πολύ καθαρά τις διαδικασίες τήξης και άλλους μετασχηματισμούς φάσεων, επιτρέπει τη διερεύνηση των διαγραμμάτων φάσεων μέσω των θερμοκρασιών τήξης και ακόμη και των ενθαλπιών. Το σήμα TGA υποδεικνύει όχι μόνο την εξάτμιση του δείγματος αλλά και στάδια απώλειας μάζας λόγω της διάσπασης, για παράδειγμα, ουσιών πρόσμιξης, οι οποίες μπορούν να προσδιοριστούν και να ποσοτικοποιηθούν σε αρκετές περιπτώσεις.