Céramiques & Verre
Gypse et Sable Quartz — Phases de Transition
Le gypse et le sable quartz sont utilisé, par exemple, dans le plâtre ou les mortiers.
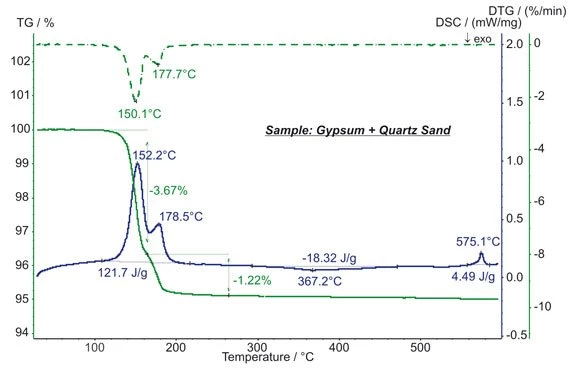
Le gypse contenu dans l’échantillon présente 2 étapes d’évaporation de H2O : CaSO4*2H2O (di-hydraté) en CaSO4*1/2H2O (demi-hydraté) et finalement en CaSO4 (anhydrite). Cela nécessite une énergie totale de 122 J/g. L’analyse quantitative révèle que l’échantillon contient 23.4% de pur di-hydraté. Entre 300°C et 450°C, la formation ExothermiqueA sample transition or a reaction is exothermic if heat is generated.exothermique de β-CaSO4 avec une énergie de 18.3 J/g a lieu. L’effet EndothermiqueA sample transition or a reaction is endothermic if heat is needed for the conversion.endothermique à une température onset extrapolée de 573°C est dû la transition structurale α→β du quartz ( SiO2 cristalline). (mesure avec STA 449 F1 Jupiter®®)