Introdução
A dolomita é um mineral composto de carbonato de cálcio e magnésio, quimicamente conhecido como CaMg(CO3)2. É um recurso natural essencial com importância técnica significativa em vários setores. Uma aplicação importante é no setor de construção, onde a dolomita é utilizada como material de construção e agregado no concreto. Sua dureza e durabilidade a tornam um componente ideal para a base de estradas, blocos de concreto e asfalto. A resistência da dolomita às intempéries e à erosão aumenta ainda mais seu valor em projetos de infraestrutura.
Entender a proporção de cálcio e magnésio na dolomita é fundamental para otimizar suas aplicações. A variação das proporções desses elementos pode afetar significativamente as propriedades físicas e químicas do mineral, como solubilidade, taxas de reação e estrutura cristalina. Ao conhecer e controlar essa proporção, os fabricantes podem adaptar a dolomita para aplicações específicas, garantindo as características e o desempenho desejados.
Resultados e discussão
Para investigar a relação Ca/Mg da dolomita, foram realizadas medições com o NETZSCH STA 449 F3 Jupiter® usando diferentes atmosferas de gás. Uma compilação detalhada das condições de medição pode ser encontrada na tabela 1.
Tabela 1: Parâmetros de medição
| Instrumento | STA 449 F3 Jupiter® |
| Forno | Forno de carbeto de silício |
| Sensor | Tipos de TG-DSC |
| Cadinho | 85 μl de Al2O3 com tampa perfurada |
| Programa de temperatura | 40°C - 1200°C mit a K/min |
| Atmosfera | 70 ml/min de ar sintético ou dióxido de carbono |
| Massa da amostra | aprox. 40 mg |
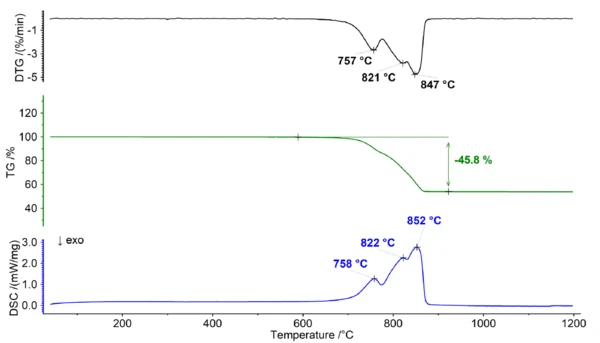
Comportamento térmico da dolomita ao ar
Quando a dolomita é aquecida na presença de oxigênio, ela sofre Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição térmica. A Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. reação de decomposição pode ser representada da seguinte forma:
CaMg(CO3)2 → CaO + MgO + 2CO2 (1)
Durante esse processo de Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição (veja a figura 1), a dolomita sólida se decompõe em óxido de cálcio (CaO), óxido de magnésio (MgO) e gás de dióxido de carbono (CO2). Essa reação ocorre em temperaturas acima de 700°C e resulta em uma ampla etapa de perda de massa que apresenta vários picos no sinal de DTG e DSC. A característica de sobreposição da perda de massa prejudica significativamente a capacidade de atribuir etapas distintas na curva de TGA, impossibilitando, assim, a determinação de qualquer informação adicional sobre a relação Ca/Mg da dolomita.
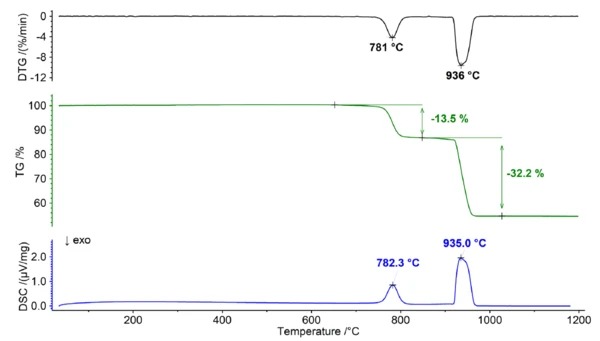
Comportamento térmico da dolomita em uma atmosfera de dióxido de carbono
Na presença de uma atmosfera contendo dióxido de carbono, a dolomita apresenta um comportamento diferente devido à natureza reversível da Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. reação de decomposição e à estabilidade variável dos carbonatos envolvidos. A Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. reação de decomposição (1) também pode ser representada como duas reações de equilíbrio individuais, como segue:
MgCO3 → MgO +CO2 (2)
CaCO3 → CaO +CO2 (3)
O equilíbrio entre os reagentes e os produtos da reação é afetado por vários fatores, incluindo a temperatura e as concentrações deCO2. Quando o dióxido de carbono está presente de forma consistente, ele tem um impacto no equilíbrio, causando uma mudança em direção à estabilização dos carbonatos e resultando em uma temperatura de Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição mais alta. Esse efeito é mais proeminente para o carbonato de cálcio do que para o carbonato de magnésio devido à sua larger. Energia de Gibbs de Formação. Como resultado, a Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição do carbonato de cálcio e do carbonato de magnésio pode ser claramente distinguida quando medida em uma atmosfera de dióxido de carbono puro (consulte a figura 2). Essa separação oferece uma oportunidade de determinar com precisão a relação Ca/Mg da dolomita, pois a etapa inicial pode ser atribuída à Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição do MgCO3 (reação 2), enquanto a etapa subsequente corresponde à decomposição do CaCO3 (reação 3).
Conclusão
Selecta escolha da atmosfera ideal afeta significativamente a qualidade e a quantidade de informações obtidas por meio de medições termoanalíticas. Um exemplo desse fenômeno é dado na análise térmica apresentada de uma amostra de dolomita. Nesse caso, a transição de uma atmosfera de ar convencional para a escolha um pouco mais não convencional de dióxido de carbono resultou em um impacto notável nas propriedades térmicas medidas da dolomita analisada. Como consequência, informações totalmente novas, como a relação Ca-Mg, tornaram-se acessíveis.