Introdução
Os hidrocarbonetos policíclicos aromáticos (PAHs) são formados durante processos naturais e antropogênicos, como erupções vulcânicas, incêndios florestais, refino de petróleo ou produção de aço. Como consequência, eles são liberados na atmosfera e, devido à sua hidrofobicidade, acumulam-se no solo e podem, portanto, entrar na cadeia alimentar.arcVários experimentos demonstraram que os PAHs são potentes mutagênicos e cancerígenos [1]. O processo de dessorção térmica da remoção da contaminação por PAH do solo pode ser facilmente monitorado por análise térmica [2]. A combinação de DSC e themogravimetria documenta aTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão e a perda de massa como uma indicação da evaporação de voláteis. Neste trabalho, a análise térmica simultânea (STA) foi realizada usando instrumentos STA 449 Jupiter® para obter os pontos deTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão e ebulição, bem como a pressão de vapor de três PAHs exemplares, a saber, naftaleno, antraceno e benzo(a)pireno.
Esses compostos aromáticos foram adquiridos pela Alfa Aesar em alta pureza (naftaleno 99,6%, antraceno 99%, benzo(a) pireno 96%).
Pontos de fusão e ebulição
O analisador térmico simultâneo NETZSCH modelo STA 449 F3 Jupiter® equipado com um transportador de amostras TG-DSC tipo S, foi usado para a determinação dos pontos deTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão e ebulição. Cadinhos de alumínio selados com um orifício de 50 μm foram utilizados para essas medições.libraA termometria do instrumento STA foi baseada em uma comparação com os padrões deTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão de índio, alumínio e ouro e verificada com zinco para obter uma precisão de 1 K. O nitrogênio foi usado como gás de purga com uma taxa de fluxo de 70 ml/min e o aquecimento até 600°C foi feito a uma taxa de aquecimento constante de 10 K/min. A massa da amostra foi de aproximadamente 20 mg.
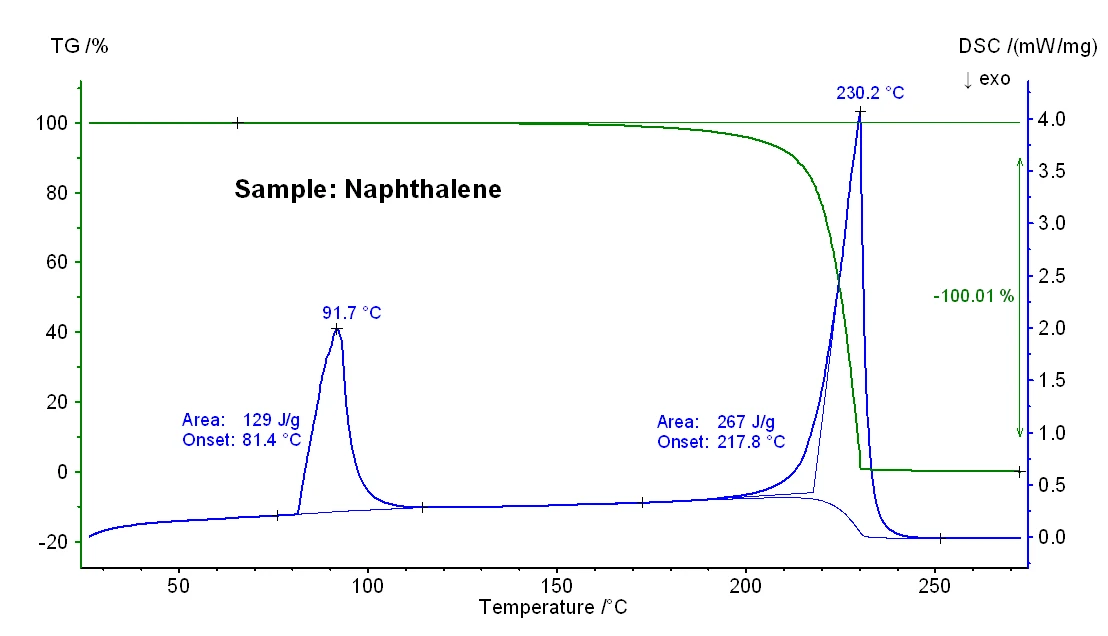
A Figura 1 mostra as alterações de massa dependentes da temperatura e o sinal DSC de uma amostra de naftaleno. Em uma temperatura de início extrapolada de 81°C, foi detectado um efeito DSC EndotérmicoUma transição de amostra ou uma reação é endotérmica se for necessário calor para a conversão.endotérmico com uma entalpia de 129 J/g, que se deve à fusão. A temperatura de início extrapolada corresponde à temperatura deTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão; na temperatura de pico de 92°C, a amostra está totalmente fundida. Uma etapa de perda de massa de 100% ocorreu entre aproximadamente 150°C e 230°C, o que reflete a evaporação da amostra. Esse efeito foi acompanhado por um pico EndotérmicoUma transição de amostra ou uma reação é endotérmica se for necessário calor para a conversão.endotérmico de DSC com uma entalpia de 267 J/g e uma temperatura de início extrapolada de 218°C. Esta última reflete o ponto de ebulição da amostra.
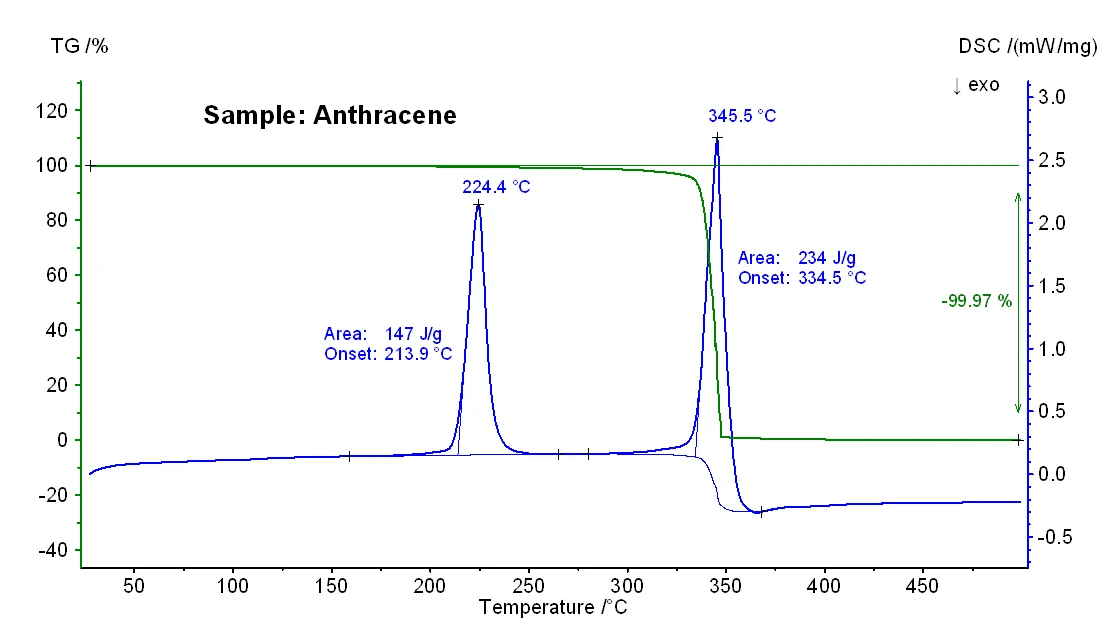
Os resultados de TG-DSC obtidos para as amostras de antraceno e benzo(a)pireno são mostrados nas figuras 2 e 3, e as temperaturas significativas de fusão e ebulição podem ser vistas na tabela 1 abaixo. Em geral, sabe-se que as temperaturas de ebulição obtidas em uma medição de DSC podem depender da taxa de aquecimento, da massa inicial da amostra e também da preparação da amostra [3].
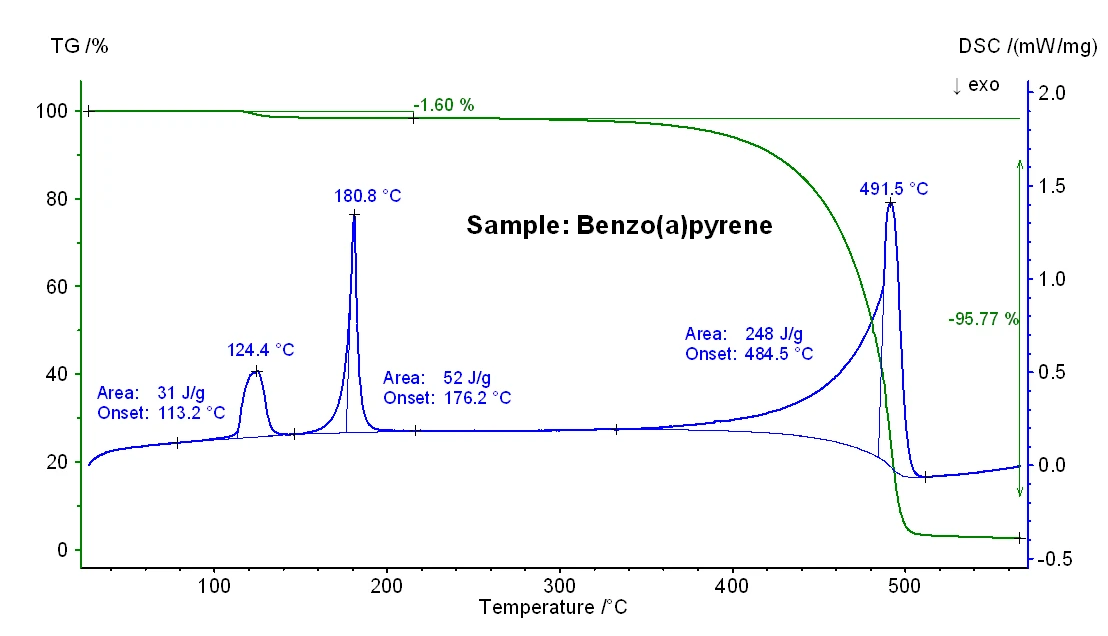
Além disso, deve-se observar que uma etapa adicional de perda de massa de 1,6%, bem como um efeito EndotérmicoUma transição de amostra ou uma reação é endotérmica se for necessário calor para a conversão.endotérmico com uma entalpia de 31 J/g, foram observados para a amostra de benzo(a)pireno (consulte a figura 3), o que provavelmente se deve à liberação de umidade. Esse achado está de acordo com a menor pureza nominal dessa amostra (veja a introdução).
Tabela 1: Comparação das temperaturas de fusão e ebulição nominais (entre parênteses, fornecidas pelo fornecedor Alfa Aesar) e medidas
| Naftaleno | Antrazeno | Benzo(a)pireno | |
|---|---|---|---|
| Temperatura de fusão | 81°C (80°C - 82°C) | 214°C (214°C - 218°C) | 176°C (177°C - 180°C) |
| Temperatura de ebulição | 218°C (218°C) | 335°C (340°C - 342°C) | 484°C (495°C) |
Pressão de vapor
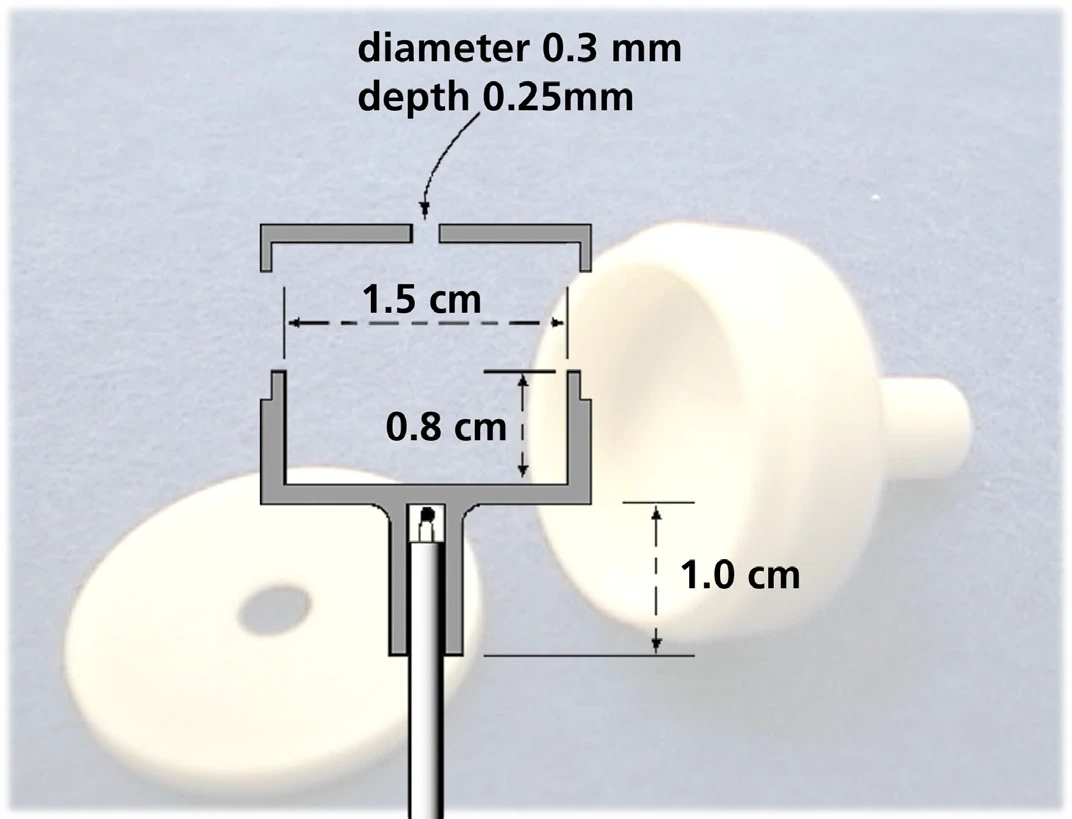
A determinação da pressão de vapor foi realizada com um analisador térmico simultâneo STA 449 F1 Jupiter® . Em vez de um cadinho padrão, a célula de Knudsen foi montada em um suporte de amostra TG com termopar tipo S (veja a figura 4).
A pressão de vapor pode ser obtida de acordo com o método de efusão de Knudsen [4]. Esse método descreve a evaporação de um material de amostra por meio de um orifício definido da célula de Knudsen em alto vácuo. O instrumento STA foi, portanto, permanentemente evacuado durante a medição usando uma bomba turbo-molecular que atingiu cerca de 10-5 mbar fora da célula de Knudsen. A pressão dentro da célula de Knudsen é igual à pressão de vapor da amostra.
O material da amostra em evaporação flui através do orifício da célula de Knudsen, levando a uma taxa de perda de massa Δm/Δt, que é a quantidade de medição. A pressão de vapor pode ser calculada de acordo com a fórmula da literatura:
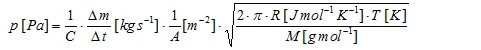
que pode então ser transformado em
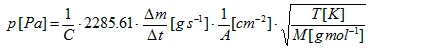
em que C é o chamado fator de correção de Clausing [4]. Esse fator, que depende da relação entre o raio r e a profundidade l do furo, pode ser aproximado para furos cilíndricos:
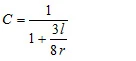
A é a área do orifício, R é a constante universal dos gases, T é a temperatura e M é a massa molar da amostra [4]. O método de efusão de Knudsen é, em geral, limitado pela medição de uma taxa de perda de massa finita, mas também pelo alto vácuo obrigatório fora da célula de Knudsen. Uma taxa de perda de massa muito alta levaria ao rompimento do vácuo.
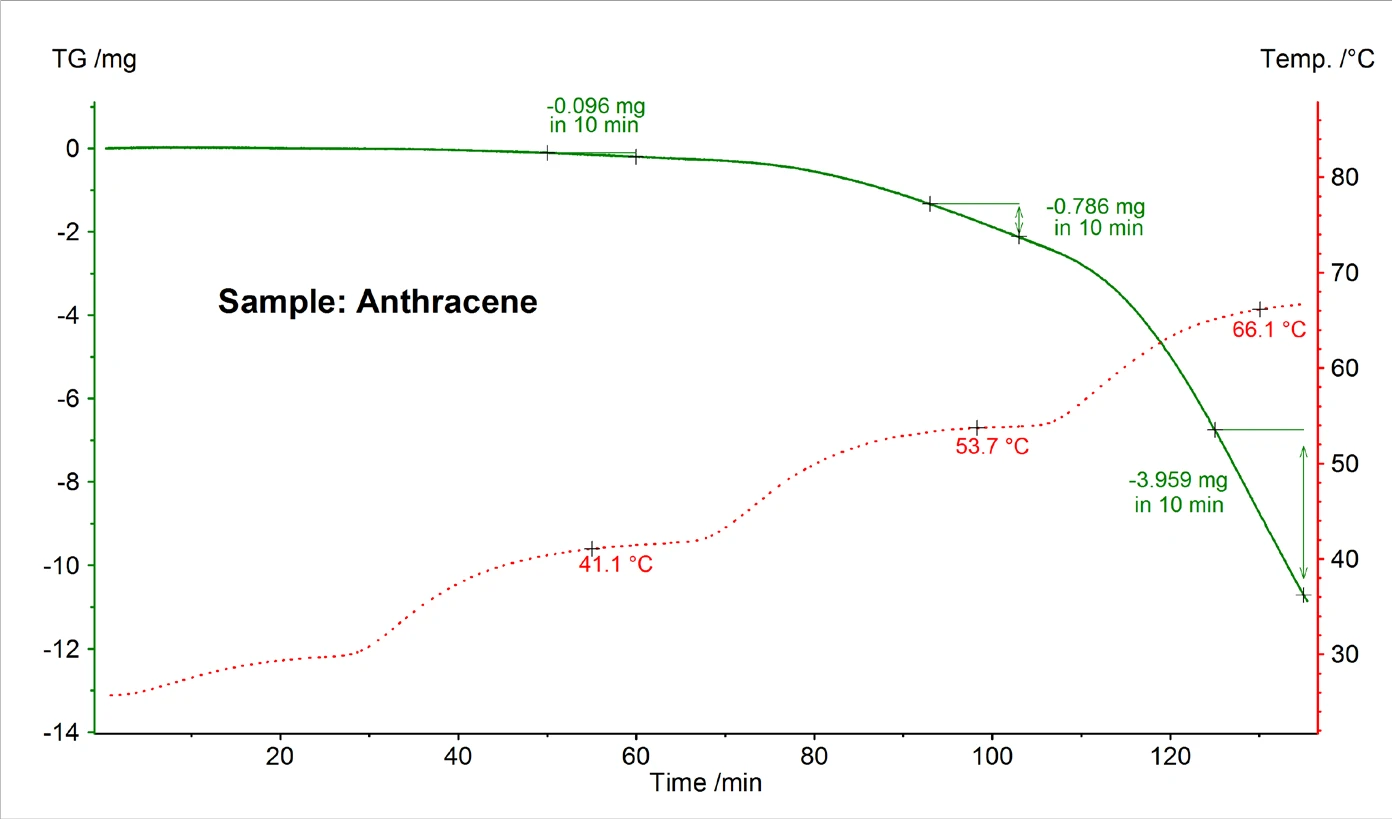
A Figura 5 mostra um exemplo de resultado de medição TG para antraceno realizada em alto vácuo usando uma célula Knudsen com um diâmetro de orifício de 0,285 cm. A partir da taxa de perda de massa detectada em diferentes temperaturas constantes, a pressão de vapor foi calculada usando as fórmulas (2) e (3).
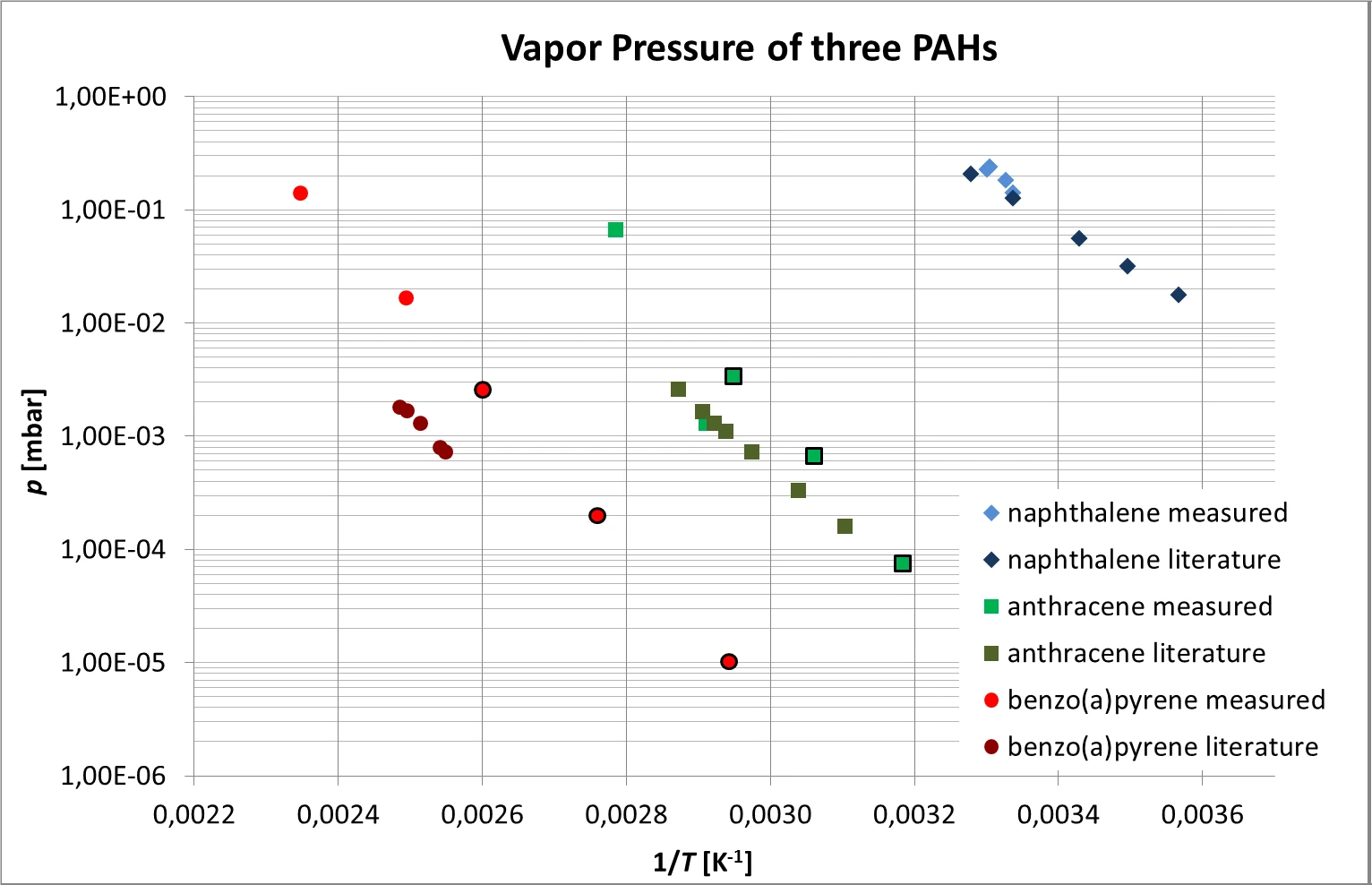
Os resultados combinados obtidos para antraceno, naftaleno e benzo(a)pireno, que seguem a dependência de temperatura exponencial esperada, podem ser vistos na figura 6. Devido à sua pressão de vapor relativamente alta, a evaporação do naftaleno só pôde ser medida perto da temperatura ambiente.
A comparação com os valores da literatura [4, 5] também é mostrada na figura 6. Uma discrepância relativamente large entre os valores medidos e os da literatura de cerca de uma ordem de magnitude foi encontrada no caso do benzo(a)pireno.
Resumo
Os pontos de fusão e ebulição do antraceno, naftaleno e benzo(a)pireno puderam ser identificados por análise térmica simultânea. Além disso, os valores de pressão de vapor foram determinados pela aplicação do método de efusão de Knudsen. Todos os resultados obtidos com os instrumentos STA 449 Jupiter® estão em boa correlação com os valores nominais e da literatura.