Introduzione
Gli idrocarburi policiclici aromatici (IPA) si formano durante processi naturali e antropici come eruzioni vulcaniche, incendi boschivi, raffinazione del petrolio o produzione di acciaio. Di conseguenza, vengono rilasciati nell'atmosfera e, a causa della loro idrofobicità, si accumulano nel suolo e possono quindi entrare nella catena alimentare. Diversi esperimenti hanno dimostrato che gli IPA sono potenti mutageni e carcinogeni [1]. Il processo di desorbimento termico della rimozione della contaminazione da IPA dal suolo può essere facilmente monitorato mediante analisi termica [2]. La combinazione di DSC e temogravimetria documenta laTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione e la perdita di massa come indicazione dell'evaporazione dei volatili. In questo lavoro, l'analisi termica simultanea (STA) è stata effettuata utilizzando gli strumenti STA 449 Jupiter® per ottenere i punti diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione e di ebollizione e la pressione di vapore di tre IPA esemplari, ovvero naftalene, antracene e benzo(a)pirene.
Questi composti aromatici sono stati acquistati da Alfa Aesar in elevata purezza (naftalene 99,6%, antracene 99%, benzo(a) pirene 96%).
Punti di fusione e di ebollizione
L'analizzatore termico simultaneo NETZSCH modello STA 449 F3 Jupiter® per la determinazione dei punti diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione e di ebollizione. Per queste misure sono stati utilizzati crogioli di alluminio sigillati con un foro di 50 μm. La termometria dello strumento STA è stata basata su una calibratificazione con standard diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione di indio, alluminio e oro e verificata con lo zinco per un'accuratezza di 1 K. L'azoto è stato utilizzato come gas di spurgo con una portata di 70 ml/min e il riscaldamento fino a 600°C è stato effettuato con una velocità di riscaldamento costante di 10 K/min. La massa del campione era di circa 20 mg.
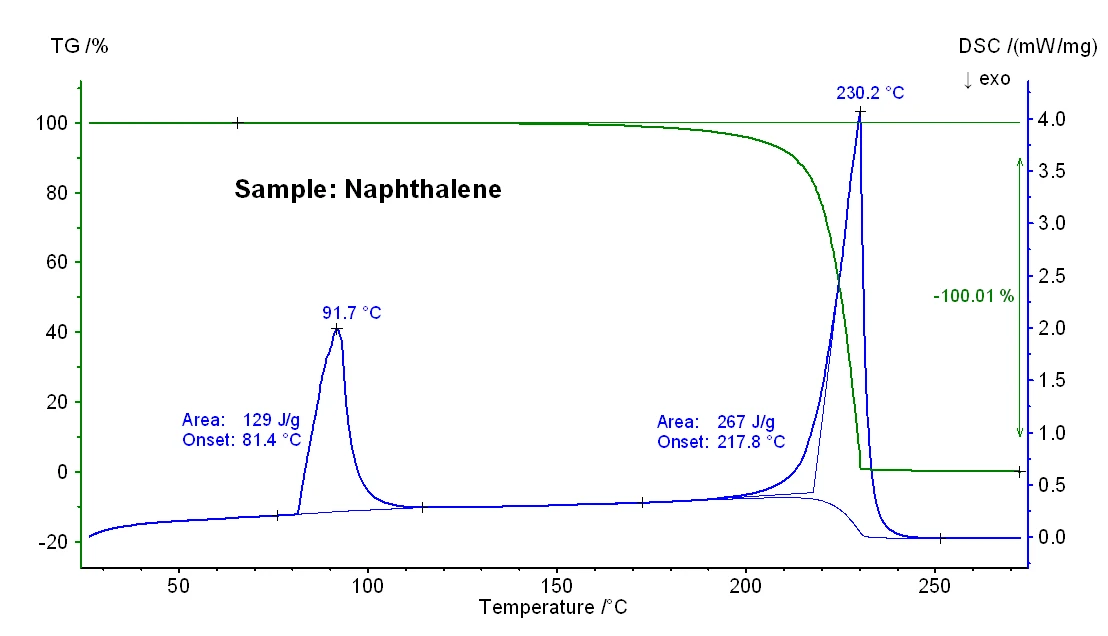
La Figura 1 illustra le variazioni di massa in funzione della temperatura e il segnale DSC di un campione di naftalene. Alla temperatura di insorgenza estrapolata di 81°C, è stato rilevato un effetto DSC EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico con un'entalpia di 129 J/g, dovuto allaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione. La temperatura di insorgenza estrapolata corrisponde allaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). temperatura di fusione, mentre alla temperatura di picco di 92°C il campione è completamente fuso. Tra circa 150°C e 230°C si è verificata una perdita di massa del 100%, che riflette l'evaporazione del campione. Questo effetto è stato accompagnato da un picco EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico DSC con un'entalpia di 267 J/g e una temperatura di insorgenza estrapolata di 218°C. Quest'ultima riflette il punto di ebollizione del campione. Quest'ultima riflette il punto di ebollizione del campione.
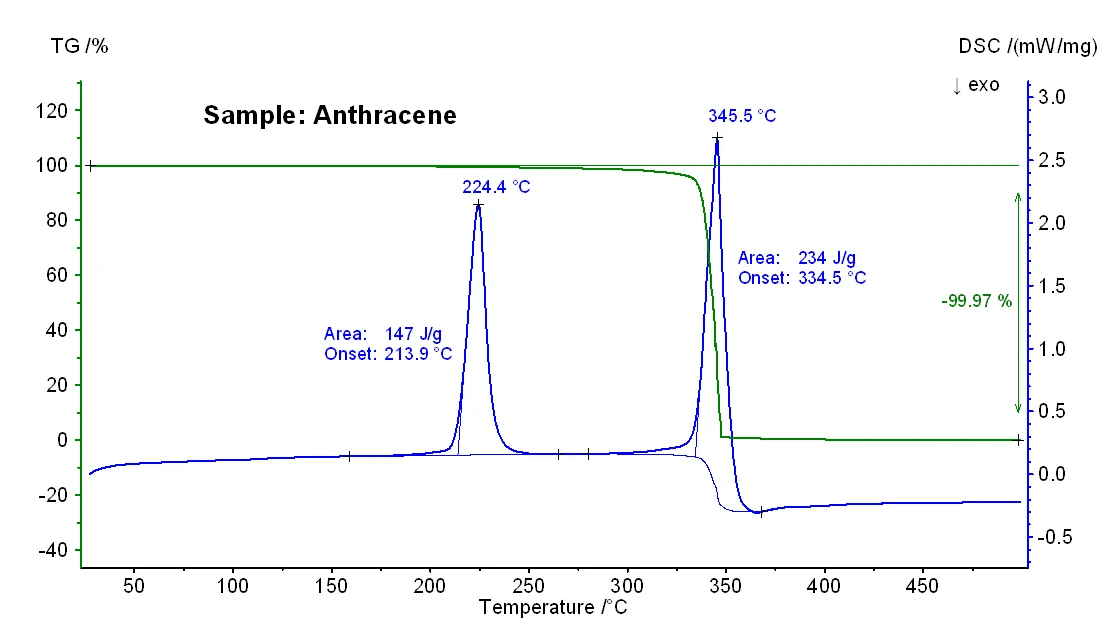
I risultati TG-DSC ottenuti per i campioni antracene e benzo(a)pirene sono mostrati nelle figure 2 e 3 e le temperature significative di fusione ed ebollizione sono riportate nella tabella 1. In generale, è noto che le temperature di ebollizione ottenute da una misura DSC possono dipendere dalla velocità di riscaldamento, dalla massa iniziale del campione e anche dalla sua preparazione [3].
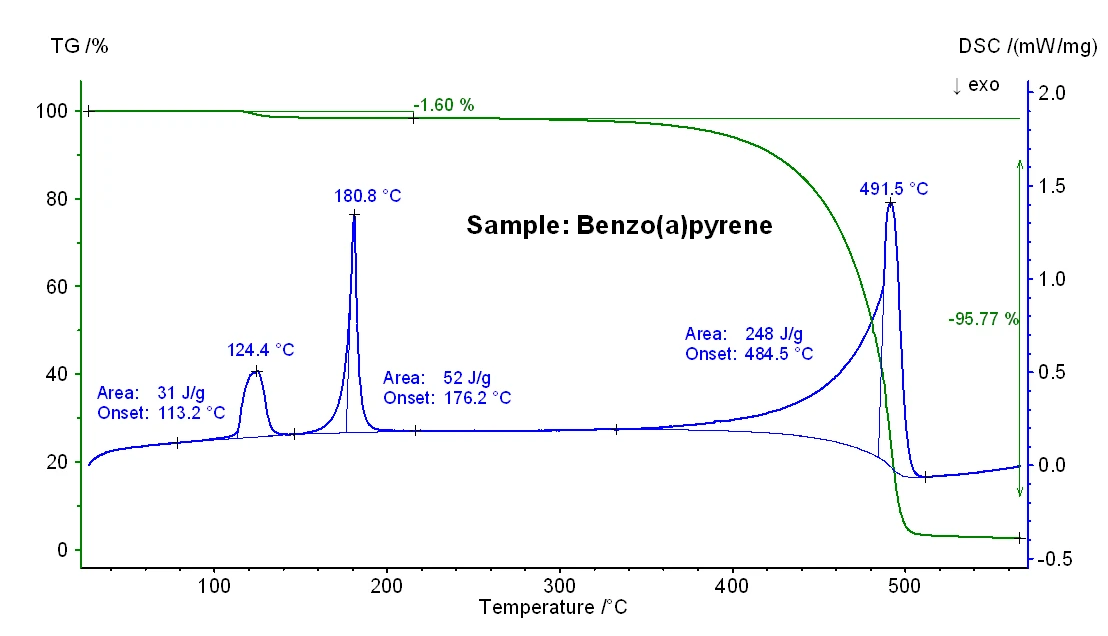
Inoltre, va notato che per il campione di benzo(a)pirene è stata osservata un'ulteriore perdita di massa dell'1,6% e un effetto EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico con un'entalpia di 31 J/g (vedi figura 3), molto probabilmente dovuto al rilascio di umidità. Questo risultato è in accordo con la minore purezza nominale di questo campione (vedi introduzione).
Tabella 1: Confronto tra le temperature di fusione e di ebollizione nominali (tra parentesi, fornite dal fornitore Alfa Aesar) e misurate
| Naftalene | Antrazene | Benzo(a)pirene | |
|---|---|---|---|
| Temperatura di fusione | 81°C (80°C - 82°C) | 214°C (214°C - 218°C) | 176°C (177°C - 180°C) |
| Temperatura di ebollizione | 218°C (218°C) | 335°C (340°C - 342°C) | 484°C (495°C) |
Pressione del vapore
La determinazione della pressione di vapore è stata realizzata con un analizzatore termico simultaneo STA 449 F1 Jupiter® . Invece di un crogiolo standard, la cella di Knudsen è stata montata su un portacampioni TG con termocoppia di tipo S (vedi figura 4).
La pressione di vapore può essere ottenuta secondo il metodo dell'effusione di Knudsen [4]. Questo metodo descrive l'evaporazione di un materiale campione attraverso un foro definito della cella di Knudsen nel vuoto spinto. Lo strumento STA è stato quindi evacuato in modo permanente durante la misurazione utilizzando una pompa molecolare turbo che ha raggiunto circa 10-5 mbar all'esterno della cella di Knudsen. La pressione all'interno della cella di Knudsen è pari alla pressione di vapore del campione.
Il materiale del campione in evaporazione fluisce attraverso il foro della cella di Knudsen, determinando un tasso di perdita di massa Δm/Δt che rappresenta la grandezza di misura. La pressione di vapore può essere calcolata secondo la formula di letteratura:
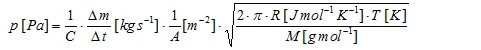
che può essere trasformato in
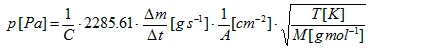
dove C è il cosiddetto fattore di correzione di Clausing [4]. Questo fattore, che dipende dal rapporto tra il raggio r e la profondità l del foro, può essere approssimato per fori cilindrici:
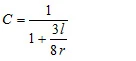
A è l'area del foro, R è la costante universale dei gas, T è la temperatura e M è la massa molare del campione [4]. Il metodo di effusione di Knudsen è in generale limitato dalla misurazione di un tasso di perdita di massa finito, ma anche dall'obbligo di un alto vuoto all'esterno della cella di Knudsen. Un tasso di perdita di massa molto elevato porterebbe alla rottura del vuoto.
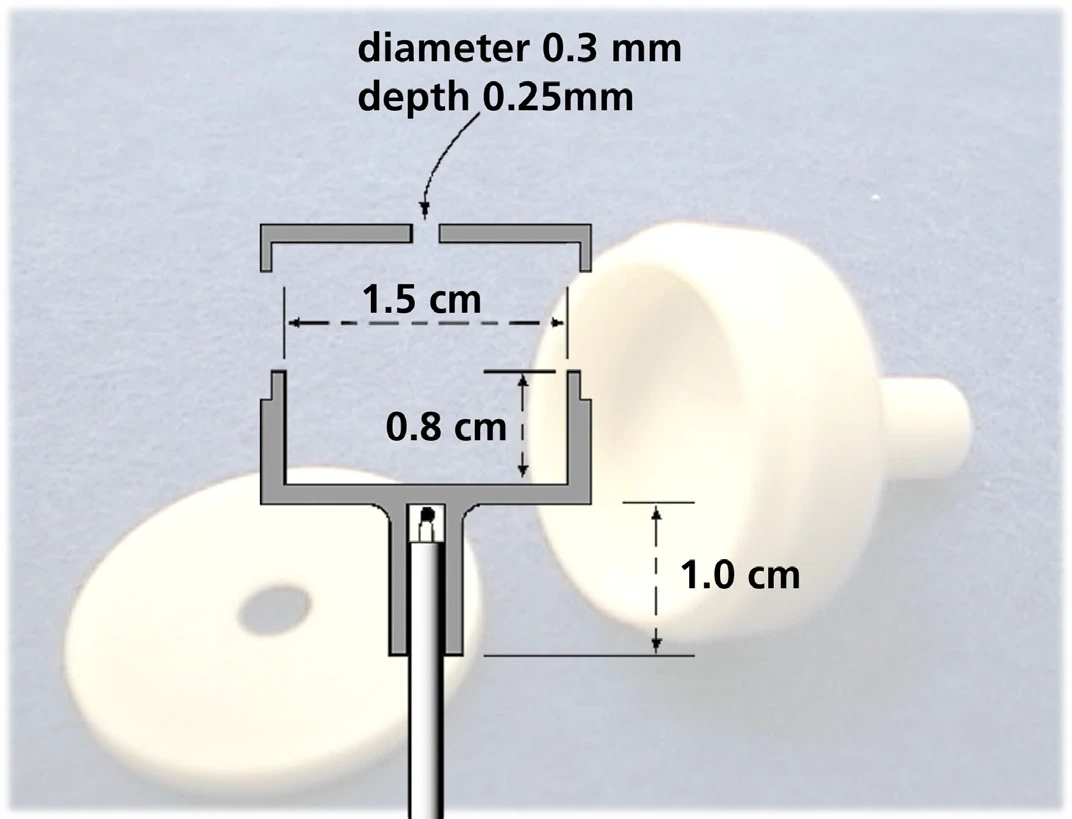
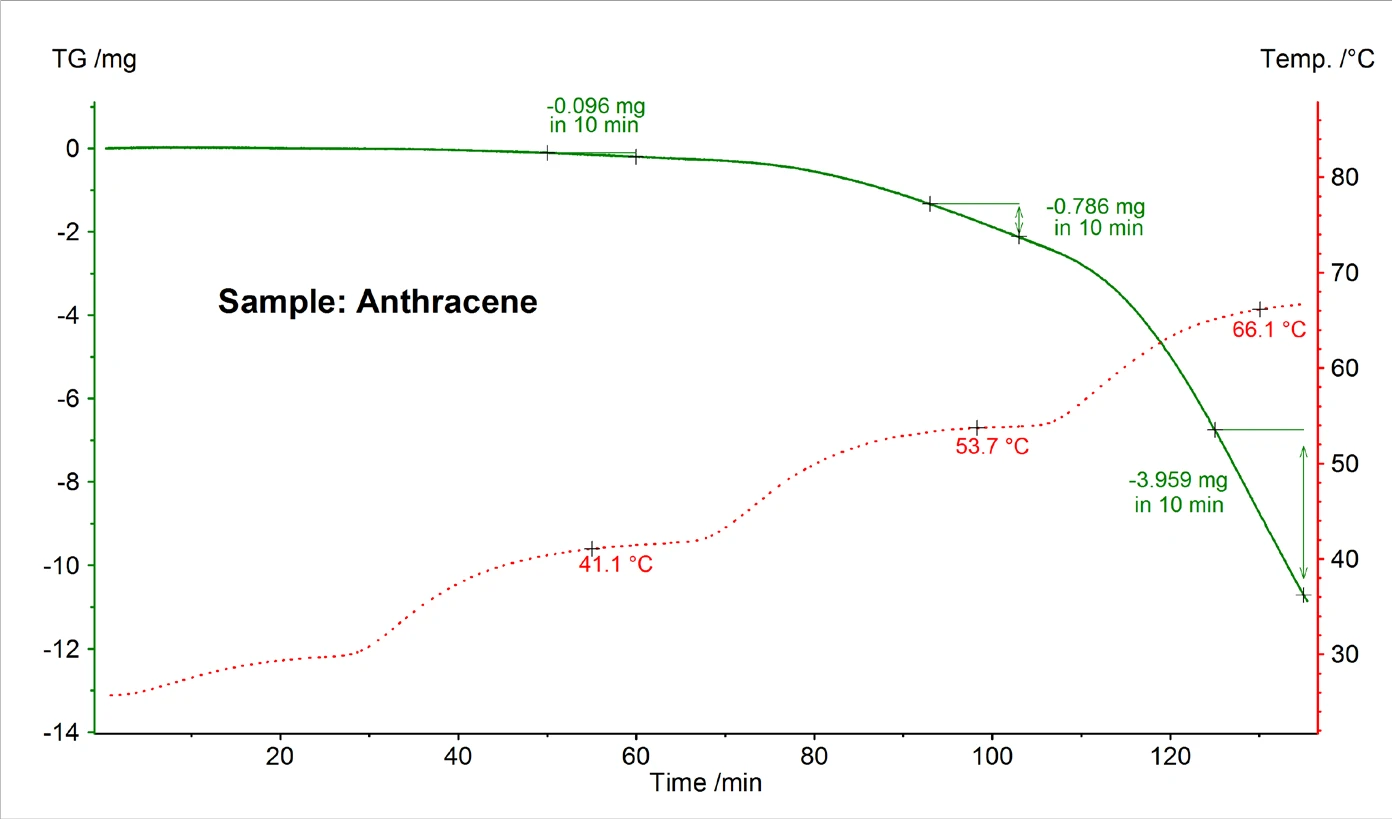
La Figura 5 mostra un esempio di misurazione TG dell'antracene eseguita in alto vuoto utilizzando una cella di Knudsen con un diametro del foro di 0,285 cm. Dal tasso di perdita di massa rilevato a diverse temperature costanti, la pressione di vapore è stata calcolata utilizzando le formule (2) e (3).
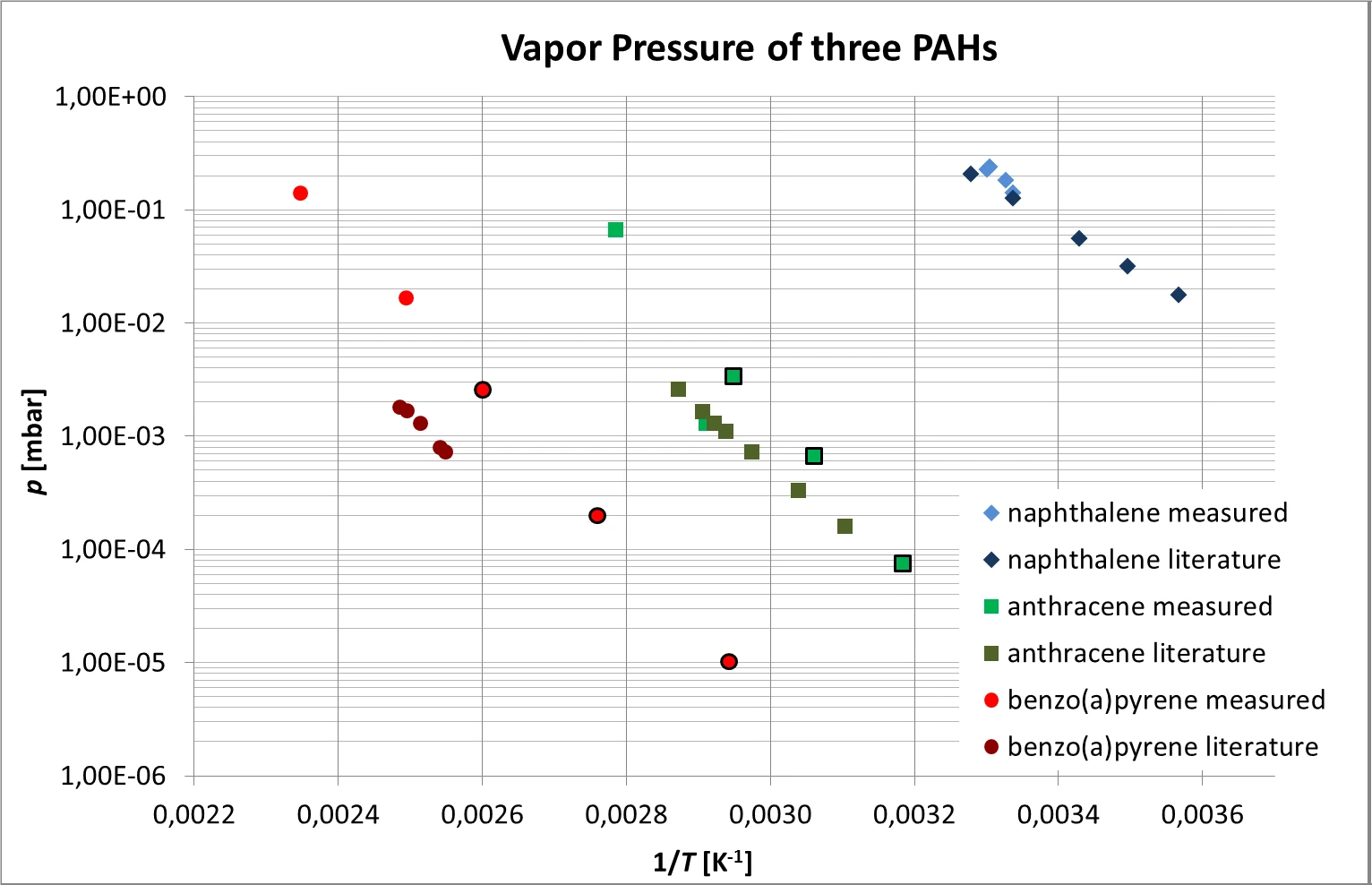
I risultati combinati ottenuti per l'antracene, il naftalene e il benzo(a)pirene, che seguono la dipendenza esponenziale dalla temperatura prevista, sono visibili in figura 6. A causa della sua pressione di vapore relativamente alta, l'evaporazione del naftalene ha potuto essere misurata solo in prossimità della temperatura ambiente.
La figura 6 mostra anche il confronto con i valori della letteratura [4, 5]. Nel caso del benzo(a)pirene è stata riscontrata una discrepanza relativamente large tra i valori misurati e quelli di letteratura di circa un ordine di grandezza.
Sintesi
I punti di fusione e di ebollizione di antracene, naftalene e benzo(a)pirene sono stati identificati mediante analisi termica simultanea. I valori di pressione di vapore sono stati inoltre determinati applicando il metodo di effusione di Knudsen. Tutti i risultati ottenuti con gli strumenti STA 449 Jupiter® sono in buona correlazione con i valori nominali e di letteratura.