Wprowadzenie
Wielopierścieniowe węglowodory aromatyczne (WWA) powstają podczas procesów naturalnych i antropogenicznych, takich jak erupcje wulkanów, pożary lasów, rafinacja ropy naftowej lub produkcja stali. W konsekwencji są one uwalniane do atmosfery, a ze względu na swoją hydrofobowość gromadzą się w glebie i mogą przedostawać się do łańcucha pokarmowego.arcRóżne eksperymenty wykazały, że WWA są silnymi mutagenami i inogenami [1]. Proces desorpcji termicznej usuwania zanieczyszczeń WWA z gleby można łatwo monitorować za pomocą analizy termicznej [2]. Połączenie DSC i termograwimetrii dokumentujeTemperatury i entalpie topnieniaEntalpia syntezy substancji, znana również jako ciepło utajone, jest miarą nakładu energii, zazwyczaj ciepła, która jest niezbędna do przekształcenia substancji ze stanu stałego w ciekły. Temperatura topnienia substancji to temperatura, w której zmienia ona stan ze stałego (krystalicznego) na ciekły (stopiony izotropowo). topnienie i utratę masy jako wskaźnik odparowania substancji lotnych. W niniejszej pracy przeprowadzono jednoczesną analizę termiczną (STA) przy użyciu przyrządów STA 449 Jupiter® w celu uzyskania temperatur topnienia i wrzenia oraz prężności par dla trzech przykładowych WWA, a mianowicie naftalenu, antracenu i benzo(a)pirenu.
Te związki aromatyczne zostały zakupione przez Alfa Aesar w wysokiej czystości (naftalen 99,6%, antracen 99%, benzo(a)piren 96%).
Temperatura topnienia i wrzenia
Symultaniczny analizator termiczny NETZSCH model STA 449 F3 Jupiter® symultaniczny analizator termiczny, wyposażony w nośnik próbek TG-DSC typu S, został użyty do wyznaczenia temperatury topnienia i wrzenia. Do pomiarów zastosowano uszczelnione tygle aluminiowe z otworem 50 μm. Termometrię przyrządu STA oparto na calibration z wzorcami topnienia indu, aluminium i złota i zweryfikowano za pomocą cynku z dokładnością do 1 K. Azot zastosowano jako gaz oczyszczający o natężeniu przepływu 70 ml/min, a ogrzewanie do 600°C przeprowadzono przy stałej szybkości ogrzewania 10 K/min. Masa próbki wynosiła około 20 mg.
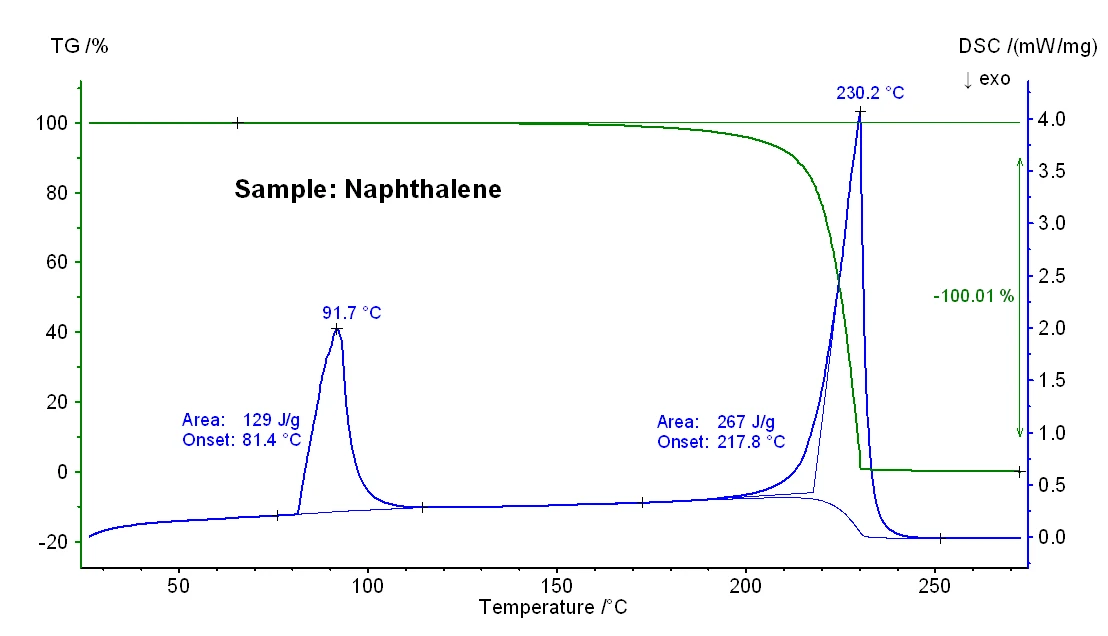
Rysunek 1 przedstawia zależne od temperatury zmiany masy i sygnał DSC próbki naftalenu. Przy ekstrapolowanej temperaturze początku 81°C wykryto EndotermicznyPrzemiana próbki lub reakcja jest endotermiczna, jeśli do konwersji potrzebne jest ciepło.endotermiczny efekt DSC z entalpią 129 J/g, który jest spowodowany topnieniem. Ekstrapolowana temperatura początku odpowiada temperaturze topnienia, w temperaturze szczytowej 92°C próbka jest w pełni stopiona. Ubytek masy wynoszący 100% wystąpił między około 150°C a 230°C, co odzwierciedla parowanie próbki. Efektowi temu towarzyszył EndotermicznyPrzemiana próbki lub reakcja jest endotermiczna, jeśli do konwersji potrzebne jest ciepło.endotermiczny pik DSC o entalpii 267 J/g i ekstrapolowanej temperaturze początku 218°C. Ta ostatnia odzwierciedla temperaturę wrzenia próbki.
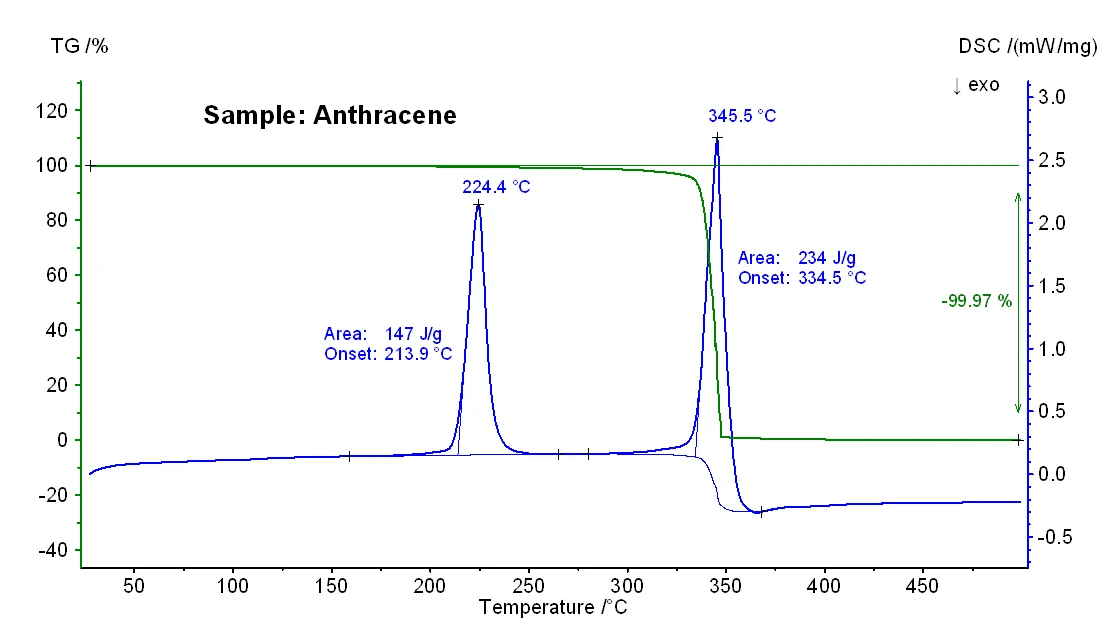
Wyniki TG-DSC uzyskane dla próbek antracenu i benzo(a)pirenu przedstawiono na rysunkach 2 i 3, a znaczące temperatury topnienia i wrzenia można zobaczyć w tabeli 1 poniżej. Ogólnie wiadomo, że szczególnie temperatury wrzenia uzyskane z pomiaru DSC mogą zależeć od szybkości ogrzewania, początkowej masy próbki, a także od przygotowania próbki [3].
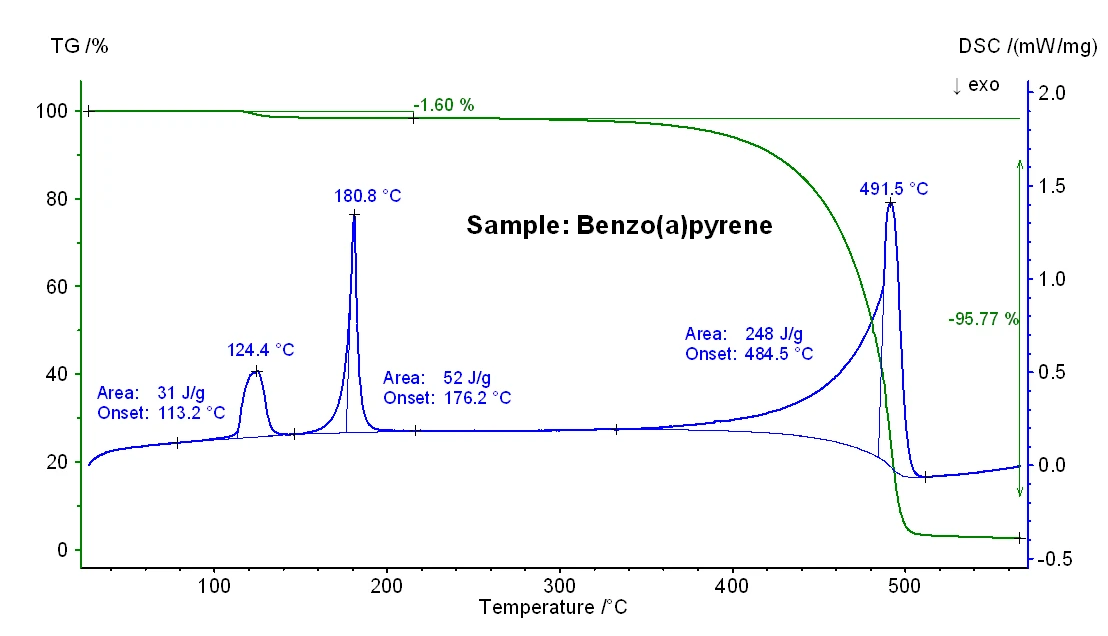
Ponadto należy zauważyć, że w przypadku próbki benzo(a)pirenu zaobserwowano dodatkowy stopień utraty masy wynoszący 1,6%, a także efekt EndotermicznyPrzemiana próbki lub reakcja jest endotermiczna, jeśli do konwersji potrzebne jest ciepło.endotermiczny o entalpii 31 J/g (patrz rysunek 3), który najprawdopodobniej jest spowodowany uwalnianiem wilgoci. Odkrycie to jest zgodne z niższą nominalną czystością tej próbki (patrz wstęp).
Tabela 1: Porównanie nominalnych (w nawiasach, podanych przez dostawcę Alfa Aesar) i zmierzonych temperatur topnienia i wrzenia
| Naftalen | Antrazen | Benzo(a)piren | |
|---|---|---|---|
| Temperatura topnienia | 81°C (80°C - 82°C) | 214°C (214°C - 218°C) | 176°C (177°C - 180°C) |
| Temperatura wrzenia | 218°C (218°C) | 335°C (340°C - 342°C) | 484°C (495°C) |
Ciśnienie pary
Określenie prężności pary przeprowadzono za pomocą symultanicznego analizatora termicznego STA 449 F1 Jupiter® . Zamiast standardowego tygla, cela Knudsena została zamontowana na nośniku próbki TG z termoparą typu S (patrz rysunek 4).
Ciśnienie pary można było uzyskać zgodnie z metodą effuzji Knudsena [4]. Metoda ta opisuje OdparowanieOdparowanie pierwiastka lub związku jest przejściem fazowym z fazy ciekłej do pary. Istnieją dwa rodzaje parowania: parowanie i wrzenie.odparowanie materiału próbki przez określony otwór celi Knudsena do wysokiej próżni. W związku z tym przyrząd STA był stale opróżniany podczas pomiaru za pomocą turbopompy molekularnej, osiągając około 10-5 mbar na zewnątrz celi Knudsena. Ciśnienie wewnątrz celi Knudsena jest równe ciśnieniu pary próbki.
Odparowujący materiał próbki przepływa przez otwór celi Knudsena, co prowadzi do szybkości utraty masy Δm/Δt, która jest wielkością mierzoną. Ciśnienie pary można obliczyć zgodnie ze wzorem literaturowym:
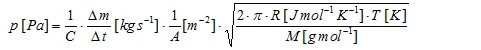
które można następnie przekształcić w
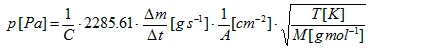
gdzie C jest tak zwanym współczynnikiem korekcji Clausinga [4]. Współczynnik ten, który zależy od stosunku promienia r do głębokości l otworu, może być przybliżony dla otworów cylindrycznych:
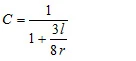
A to powierzchnia otworu, R to uniwersalna stała gazowa, T to temperatura, a M to masa molowa próbki [4]. Metoda effuzji Knudsena jest zasadniczo ograniczona przez pomiar skończonej szybkości utraty masy, ale także przez obowiązkową wysoką próżnię na zewnątrz celi Knudsena. Bardzo duża utrata masy doprowadziłaby do rozpadu próżni.
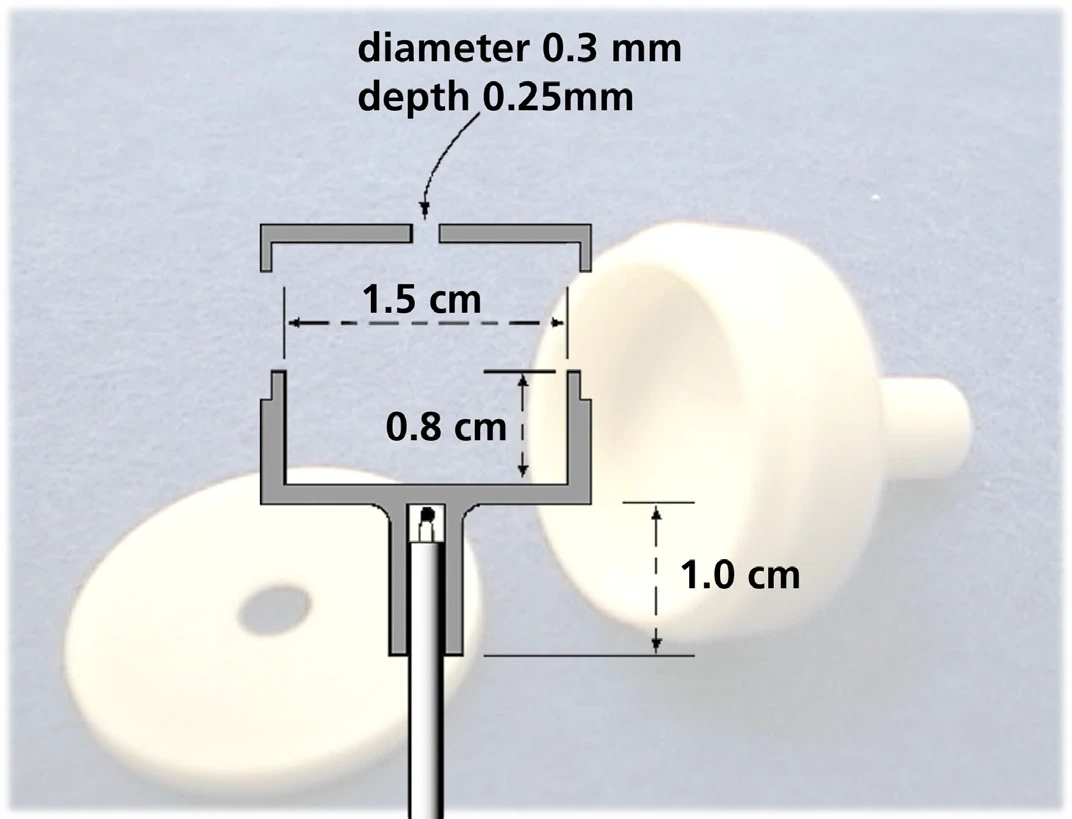
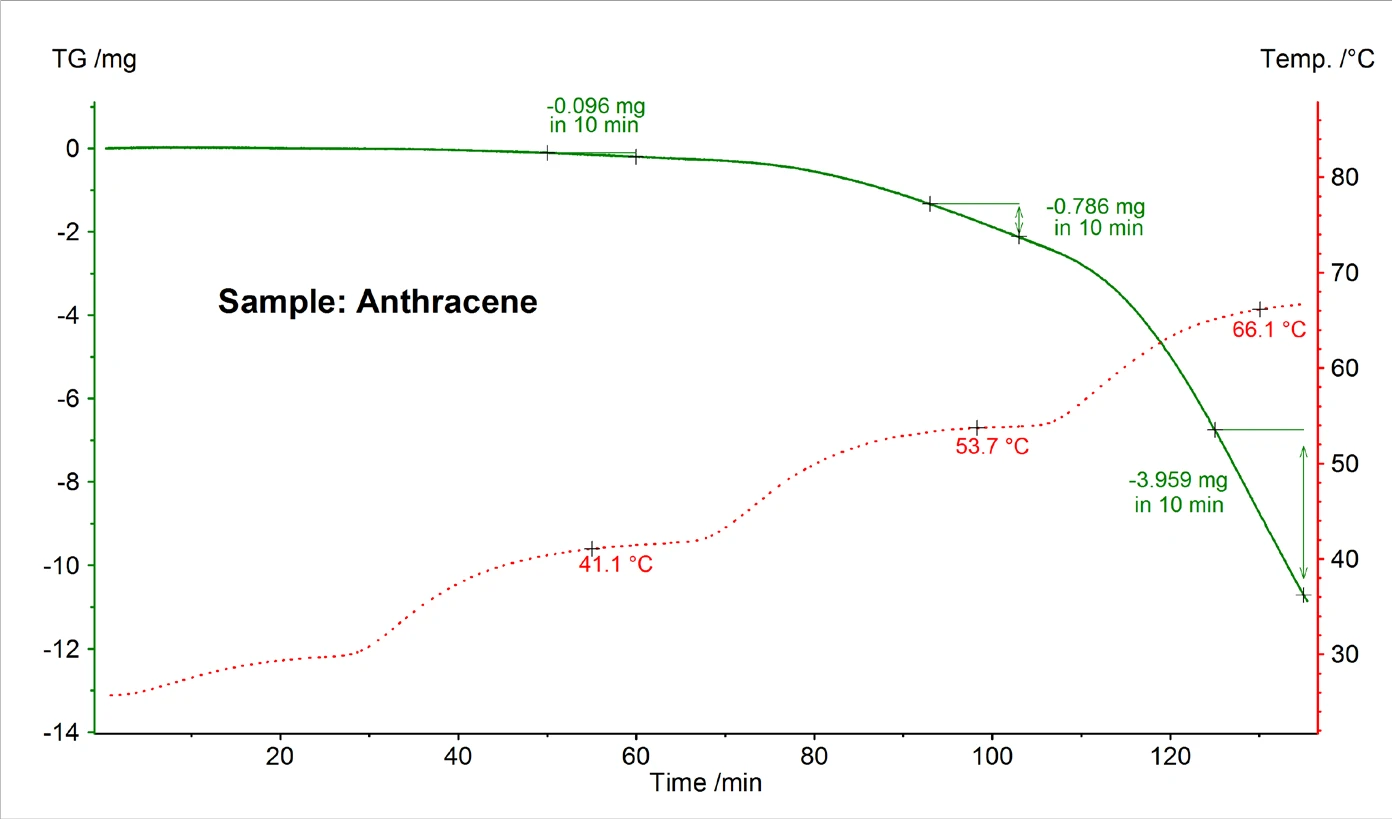
Rysunek 5 przedstawia przykładowy wynik pomiaru TG dla antracenu przeprowadzonego w wysokiej próżni przy użyciu celi Knudsena o średnicy otworu 0,285 cm. Na podstawie szybkości ubytku masy wykrytej w różnych stałych temperaturach, ciśnienie pary obliczono przy użyciu wzorów (2) i (3).
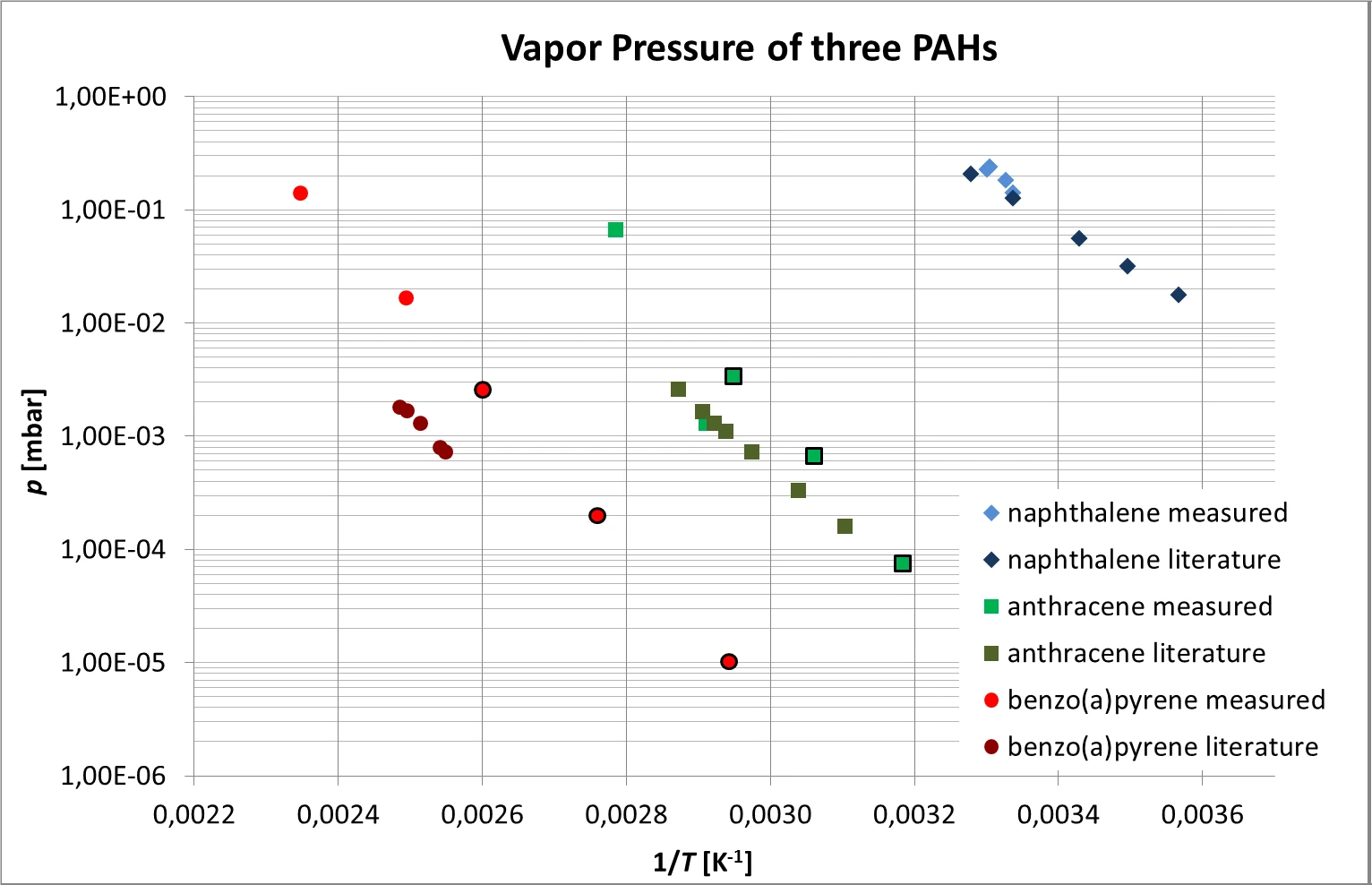
Połączone wyniki uzyskane dla antracenu, naftalenu i benzo(a)pirenu, które są zgodne z oczekiwaną wykładniczą zależnością od temperatury, można zobaczyć na rysunku 6. Ze względu na stosunkowo wysoką prężność par, OdparowanieOdparowanie pierwiastka lub związku jest przejściem fazowym z fazy ciekłej do pary. Istnieją dwa rodzaje parowania: parowanie i wrzenie.odparowanie naftalenu można było zmierzyć tylko w pobliżu temperatury pokojowej.
Porównanie z wartościami literaturowymi [4, 5] jest również pokazane na rysunku 6. W przypadku benzo(a)pirenu stwierdzono stosunkowo large dużą rozbieżność między wartościami zmierzonymi a literaturowymi, wynoszącą około jednego rzędu wielkości.
Podsumowanie
Temperatury topnienia i wrzenia antracenu, naftalenu i benzo(a)pirenu można było określić za pomocą jednoczesnej analizy termicznej. Wartości prężności par zostały ponadto określone poprzez zastosowanie metody effuzji Knudsena. Wszystkie wyniki uzyskane przy użyciu przyrządów STA 449 Jupiter® są w dobrej korelacji z wartościami nominalnymi i literaturowymi.