Введение
Доломит - это минерал, состоящий из карбоната кальция-магния, химически известного как CaMg(CO3)2. Это важный природный ресурс, имеющий большое техническое значение в различных отраслях промышленности. Одна из наиболее важных областей применения - строительная индустрия, где доломит используется в качестве строительного материала и заполнителя для бетона. Его твердость и прочность делают его идеальным компонентом для дорожного основания, бетонных блоков и асфальта. Устойчивость доломита к атмосферным воздействиям и эрозии еще больше повышает его ценность в инфраструктурных проектах.
Понимание соотношения кальция и магния в доломите имеет решающее значение для оптимизации его применения. Изменение соотношения этих элементов может существенно повлиять на физико-химические свойства минерала, такие как растворимость, скорость реакции и кристаллическая структура. Зная и контролируя это соотношение, производители могут подбирать доломит для конкретных областей применения, обеспечивая требуемые характеристики и производительность.
Результаты и обсуждение
Для изучения соотношения Ca/Mg в доломите были проведены измерения на приборе NETZSCH STA 449 F3 Jupiter® в различных газовых атмосферах. Подробное описание условий измерений приведено в таблице 1.
Таблица 1: Параметры измерений
| Прибор | STA 449 F3 Jupiter® |
| Печь | Карбидокремниевая печь |
| Датчик | Типы ТГ-ДСК |
| Крюсиль | 85 мкл Al2O3 с проколотой крышкой |
| Температурная программа | 40°C - 1200°C со скоростью K/мин |
| Атмосфера | 70 мл/мин синтетического воздуха или углекислого газа |
| Масса образца | около 40 мг |
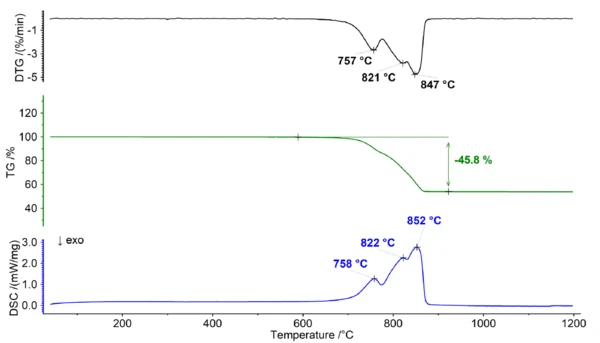
Термическое поведение доломита под воздействием воздуха
При нагревании доломита в присутствии кислорода он подвергается термическому разложению. Реакция разложения может быть представлена следующим образом:
CaMg(CO3)2 → CaO + MgO + 2CO2 (1)
В процессе разложения (см. рис. 1) твердый доломит распадается на оксид кальция (CaO), оксид магния (MgO) и газообразный диоксид углерода (CO2). Эта реакция происходит при температурах выше 700°C и приводит к широкой ступени потери массы, которая демонстрирует несколько пиков в сигналах ДТГ и ДСК. Наложение характеристик потери массы значительно затрудняет возможность выделения отдельных ступеней на кривой ТГА, что делает невозможным получение дополнительной информации о соотношении Ca/Mg в доломите.
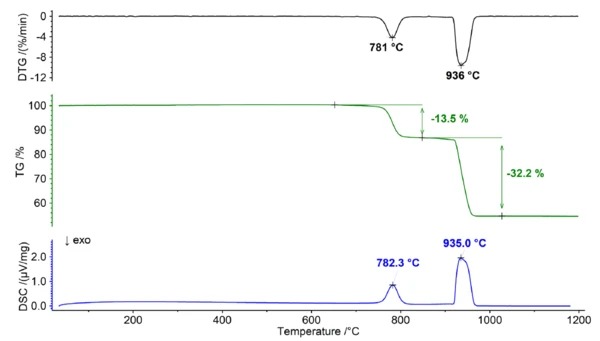
Термическое поведение доломита в атмосфере диоксида углерода
В присутствии атмосферы, содержащей диоксид углерода, доломит ведет себя по-разному из-за обратимого характера реакции разложения и различной стабильности участвующих в ней карбонатов. Реакцию разложения (1) можно также представить в виде двух отдельных равновесных реакций следующим образом:
MgCO3 → MgO +CO2 (2)
CaCO3 → CaO +CO2 (3)
На равновесие между реагентами и продуктами реакции влияют различные факторы, включая температуру и концентрациюCO2. При постоянном присутствии углекислого газа он оказывает влияние на равновесие, вызывая сдвиг в сторону стабилизации карбонатов и приводя к повышению температуры разложения. Этот эффект более заметен для карбоната кальция, чем для карбоната магния, из-за его larger. энергии Гиббса образования. В результате разложение карбоната кальция и карбоната магния можно четко разделить при измерении в атмосфере чистого диоксида углерода (см. рис. 2). Такое разделение дает возможность точно определить соотношение Ca/Mg в доломите, поскольку начальный этап можно отнести к разложению MgCO3 (реакция 2), в то время как последующий этап соответствует разложению CaCO3 (реакция 3).
Заключение
Selectион оптимальной атмосферы существенно влияет на качество и количество информации, получаемой в результате термоаналитических измерений. Примером этого явления может служить представленный термический анализ образца доломита. В данном случае переход от обычной воздушной атмосферы к чуть более нетрадиционному выбору углекислого газа оказал заметное влияние на измеренные тепловые свойства анализируемого доломита. Как следствие, стала доступна совершенно новая информация, например, соотношение Ca-Mg.