Einleitung
Dolomit ist ein Mineral, das aus Kalzium-Magnesium- Karbonat besteht, chemisch bekannt als CaMg(CO3)2. Es ist ein wichtiger natürlicher Rohstoff mit erheblicher technischer Bedeutung für verschiedene Branchen. Eine wichtige Anwendung ist die Bauindustrie, wo Dolomit als Baumaterial und Zuschlagstoff für Beton verwendet wird. Seine Härte und Haltbarkeit machen ihn zu einem idealen Bestandteil von Straßenbelägen, Betonsteinen und Asphalt. Die Witterungs- und Erosionsbeständigkeit von Dolomit steigert seinen Wert bei Infrastrukturprojekten noch weiter.
Die Kenntnis des Verhältnisses von Kalzium und Magnesium in Dolomit ist entscheidend für die Optimierung seiner Anwendungen. Unterschiedliche Verhältnisse dieser Elemente können die physikalischen und chemischen Eigenschaften des Minerals wie Löslichkeit, Reaktionsgeschwindigkeit und kristalline Struktur erheblich beeinflussen. Durch die Kenntnis und Kontrolle dieses Verhältnisses können die Hersteller Dolomit für bestimmte Anwendungen maßschneidern und die gewünschten Eigenschaften und Leistungen sicherstellen.
Ergebnisse und Diskussion
Zur Untersuchung des Ca/Mg-Verhältnisses von Dolomit wurden Messungen mit der NETZSCH STA 449 F3 Jupiter® unter verschiedenen Gasatmosphären durchgeführt. Eine detaillierte Zusammenstellung der Messbedingungen findet sich in Tabelle 1.
Tabelle 1: Messparameter
| Messgerät | STA 449 F3 Jupiter® |
| Ofen | Siliziumkarbid-Ofen |
| Sensor | TG-DSC Typ s |
| Tiegel | 85 μl Al2O3 mit gelochtem Deckel |
| Temperaturprogramm | 40 °C - 1200 °C mit at K/min |
| Atmosphäre | 70 ml/min synthetische Luft bzw. CO2 |
| Probenmasse | ca. 40 mg |
Thermisches Verhalten von Dolomit unter Luft
Wenn Dolomit in Gegenwart von Sauerstoff erhitzt wird, kommt es zu einer thermischen Zersetzung. Die ZersetzungsreaktionEine Zersetzungsreaktion ist eine thermisch induzierte Reaktion einer chemischen Substanz, die fest und/oder gasförmige Zersetzungsprodukte bildet.Zersetzungsreaktion kann wie folgt dargestellt werden:
CaMg(CO3)2 → CaO + MgO + 2 CO2 (1)
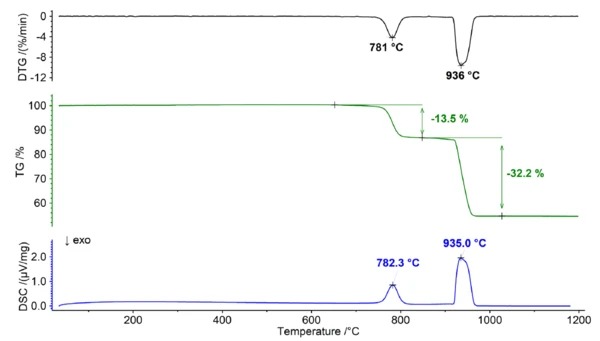
Während dieses Zersetzungsprozesses (siehe Abbildung 1) zerfällt der Dolomit in Calciumoxid (CaO), Magnesiumoxid (MgO) und Kohlendioxidgas (CO2). Diese Reaktion findet bei Temperaturen über 700 °C statt und führt zu einem breiten Massenverlust, der im DTGund DSC-Signal mehrere Peaks aufweist. Die sich überlagernde Charakteristik des Massenverlustes erschwert die Zuordnung einzelner Stufen in der TG-Kurve erheblich, so dass es unmöglich ist, zusätzliche Informationen über das Ca/Mg-Verhältnis des Dolomits zu ermitteln.
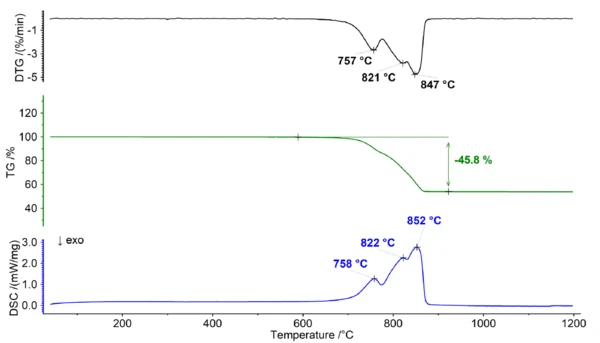
Thermisches Verhalten von Dolomit unter Kohlendioxidatmosphäre
In Gegenwart einer kohlendioxidhaltigen Atmosphäre verhält sich der Dolomit aufgrund der reversiblen Natur der Zersetzungsreaktion und der unterschiedlichen Stabilität der beteiligten Karbonate unterschiedlich. Die vorherige Zersetzungsreaktion (1) kann auch als zwei einzelne Gleichgewichtsreaktionen wie folgt dargestellt werden:
MgCO3 → MgO + CO2 (2)
CaCO3 → CaO + CO2 (3)
Das Gleichgewicht zwischen den Reaktanten und den Produkten der Reaktion wird durch verschiedene Faktoren beeinflusst, darunter die Temperatur und die CO2-Konzentration. Das Vorhandensein von Kohlendioxid wirkt sich auf das Gleichgewicht aus und bewirkt eine Verschiebung hin zur Stabilisierung der Karbonate und führt zu einer höheren Zersetzungstemperatur. Dieser Effekt ist bei Kalziumkarbonat ausgeprägter als bei Magnesiumkarbonat, da es eine höhere Gibbs'sche Bildungsenergie aufweist. Infolgedessen kann zwischen der Zersetzung von Calciumcarbonat und Magnesiumcarbonat klar unterschieden werden, wenn sie unter einer reinen Kohlendioxidatmosphäre gemessen wird (siehe Abbildung 2). Diese Trennung bietet die Möglichkeit, das Ca/Mg-Verhältnis des Dolomits genau zu bestimmen, da der erste Verlust auf die Zersetzung von MgCO3 (Reaktion 2) zurückgeführt werden kann, während der nachfolgende Schritt der Zersetzung von CaCO3 (Reaktion 3) entspricht.
Zusammenfassung
Die Wahl der optimalen Atmosphäre hat einen erheblichen Einfluss auf die Qualität und Quantität der Informationen, die durch thermoanalytische Messungen gewonnen werden können. Ein Beispiel für dieses Phänomen ist die vorgestellte thermische Analyse des Minerals Dolomit. In diesem Fall führte der Übergang von einer herkömmlichen Luftatmosphäre zu der etwas unkonventionelleren Wahl von Kohlendioxid zu einer bemerkenswerten Auswirkung auf die thermischen Eigenschaften des untersuchten Dolomits, infolgedessen völlig neue Informationen wie das Ca-Mg-Verhältnis zugänglich wurden.