Introdução
Descobriu-se que as temperaturas deTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão de vários sólidos, como determinados polímeros, ácidos graxos, líquidos Ionic e compostos farmacêuticos, são substancialmente reduzidas na presença de dióxido de carbono supercrítico (scCO2) devido à solubilidade doCO2 naTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão. Esse efeito pode ser benéfico para o processamento ou a CristalizaçãoA cristalização é o processo físico de endurecimento durante a formação e o crescimento de cristais. Durante esse processo, o calor da cristalização é liberado.cristalização dos materiais a partir de seus fundidos, especialmente se eles forem termicamente sensíveis. A suscetibilidade de um material à depressão do Temperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica).ponto de fusão na presença de scCO2 pode ser explorada com o uso de DSC de alta pressão (HP-DSC) para medir aTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). temperatura de fusão do material sob pressões elevadas deCO2, mesmo sem atingir condições supercríticas. Neste estudo, foi investigado o efeito de altas pressões de dióxido de carbono no Temperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica).ponto de fusão do composto farmacêutico piroxicam, um medicamento anti-inflamatório não esteroidal (AINE). Quatro formas cristalinas anidras (polimorfos) desse composto foram registradas [1]. A forma I, disponível comercialmente, com umaTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). temperatura de fusão de aproximadamente 201°C, é a forma cristalina mais estável. Foi demonstrado que o Temperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica).ponto de fusão da forma I é substancialmente deprimido na presença de scCO2 [1]. Como o piroxicam se decompõe naTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão, a redução do Temperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica).ponto de fusão do composto pode ser benéfica para o crescimento de outras formas cristalinas (por exemplo, a forma III) a partir daTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão que são difíceis de acessar por CristalizaçãoA cristalização é o processo físico de endurecimento durante a formação e o crescimento de cristais. Durante esse processo, o calor da cristalização é liberado.cristalização a partir de soluções em solventes orgânicos.
Detalhes experimentais
O piroxicam (TCI America) foi usado como recebido. As medições de DSC foram realizadas com o NETZSCH DSC 204 HP Phoenix® em amostras de 4-6 mg em cadinhos de alumínio abertos de 25 μL. As amostras foram aquecidas a 10 K/min sob um fluxo de N2 ouCO2 com pressões que variaram de 1 a 40 bar a uma taxa de fluxo de 100 mL/min ou sob uma atmosfera estáticade CO2 para atingir pressões de >55 bar.libraUm padrão de índio foi usado para verificar a variação de temperatura do instrumento, que não variou sob as diferentes atmosferas e pressões.
Resultados
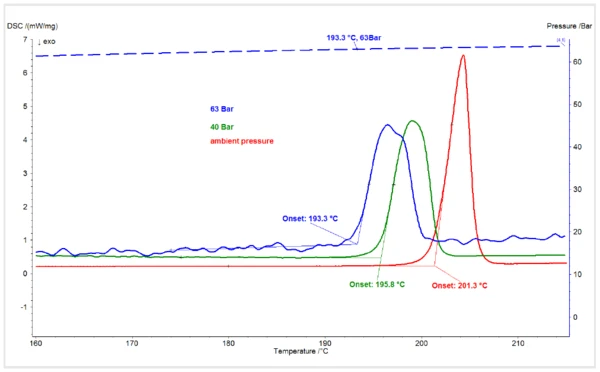
A Figura 1 mostra as transições deTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão nas curvas DSC da forma I do piroxicam sob pressão ambiente deCO2 e pressões deCO2 de 40 bar e 63 bar. Enquanto as medições à pressão ambiente e a 40 bar foram realizadas sob um fluxo dinâmico deCO2, a medição a 63 bar foi realizada sob uma atmosfera estática deCO2 em um sistema fechado. A pressão máxima de 55 bar do tanque deCO2 foi admitida no HP-DSC à temperatura ambiente, e o sistema foi fechado para que a pressão aumentasse com o aquecimento, atingindo 63 bar no início da fusão da amostra. A temperatura de início extrapolada do pico de fusão do piroxicam de 201,3°C à pressão ambiente é consistente com o valor da literatura1. O início da fusão foi reduzido em aproximadamente 5,5 K para 196°C sob 40 barde CO2. Ela diminuiu em mais 2,5 K sob uma pressão deCO2 de 63 bar.
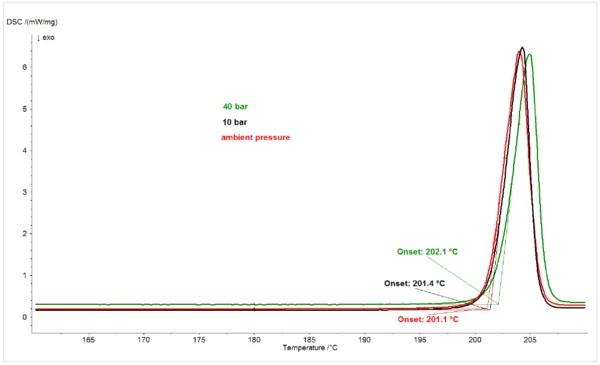
Para verificar se o efeito de depressão do Temperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica).ponto de fusão no piroxicam pelo aumento da pressãode CO2 era específico doCO2, foi examinado o efeito do aumento da pressão de N2 no comportamento de fusão do composto. A Figura 2 mostra os picos de fusão do piroxicam sob N2 à pressão ambiente, 10 bar e 40 bar. Em contraste com o efeito de depressão do ponto de fusão do aumento da pressãode CO2, o aumento da pressão de N2 causou um ligeiro aumento no ponto de fusão do piroxicam, consistente com o comportamento da maioria dos materiais, que sofrem expansão ao passar de sólidos para líquidos.
Resumo
As medições de HP-DSC mostraram que o piroxicam sofre uma depressão no ponto de fusão de aproximadamente 8 K na presença de uma atmosfera deCO2 de 63 bar em comparação com a situação na pressão ambiente. Esse estudo demonstrou a utilidade das medições de HP-DSC para a triagem de sólidos quanto à possível depressão do ponto de fusão em scCO2, mesmo quando as pressões estão abaixo do que é necessário para atingir a fase supercrítica.