Introduzione
È stato riscontrato che le temperature diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione di vari solidi, come alcuni polimeri, acidi grassi, Ionic liquidi e composti farmaceutici, si abbassano sostanzialmente in presenza di anidride carbonica supercritica (scCO2) a causa della solubilità dellaCO2 nellaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione. Questo effetto può essere vantaggioso per la lavorazione o la CristallizzazioneLa cristallizzazione è il processo fisico di indurimento durante la formazione e la crescita dei cristalli. Durante questo processo viene rilasciato il calore di cristallizzazione.cristallizzazione dei materiali dai loro fusi, soprattutto se sono termosensibili. La suscettibilità di un materiale alla depressione del Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione in presenza di scCO2 può essere esplorata utilizzando la DSC ad alta pressione (HP-DSC) per misurare laTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). temperatura di fusione del materiale a pressioni elevate diCO2, anche senza raggiungere condizioni supercritiche. In questo studio è stato analizzato l'effetto delle alte pressioni di anidride carbonica sul Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione del composto farmaceutico piroxicam, un farmaco antinfiammatorio non steroideo (FANS). Di questo composto sono state riportate quattro forme cristalline anidre (polimorfi) [1]. La forma I, disponibile in commercio, con unaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). temperatura di fusione di circa 201°C, è la forma cristallina più stabile. È stato dimostrato che il Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione della forma I si abbassa notevolmente in presenza di scCO2 [1]. Poiché il piroxicam si decompone al momento dellaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione, l'abbassamento del Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione del composto potrebbe essere vantaggioso per la crescita di altre forme cristalline (ad esempio, la forma III) dallaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione che sono difficilmente accessibili per CristallizzazioneLa cristallizzazione è il processo fisico di indurimento durante la formazione e la crescita dei cristalli. Durante questo processo viene rilasciato il calore di cristallizzazione.cristallizzazione da soluzioni in solventi organici.
Dettagli sperimentali
Il piroxicam (TCI America) è stato utilizzato come ricevuto. NETZSCH Le misure DSC sono state eseguite con il DSC 204 HP Phoenix® su campioni di 4-6 mg in crogioli di alluminio aperti da 25 μL. I campioni sono stati riscaldati a 10 K/min sotto un flusso di N2 oCO2 con pressioni comprese tra 1 e 40 bar a una velocità di flusso di 100 mL/min o sotto un'atmosfera staticadi CO2 per raggiungere pressioni di >55 bar.libraPer verificare la temperatura dello strumento è stato utilizzato uno standard di indio, che non è variato con le diverse atmosfere e pressioni.
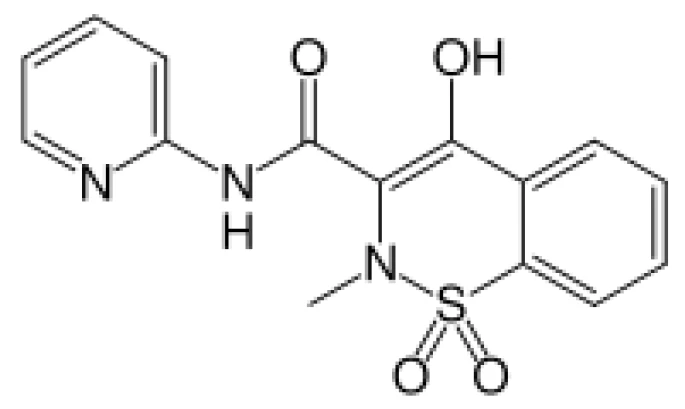
Risultati
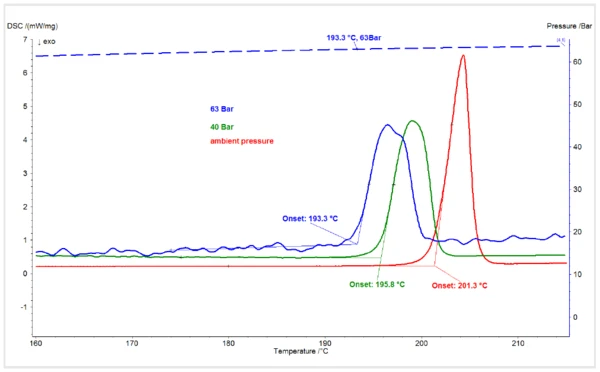
La Figura 1 mostra le transizioni diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione nelle curve DSC del piroxicam forma I a pressione ambiente diCO2 e a pressioni diCO2 di 40 bar e 63 bar. Mentre le misure a pressione ambiente e a 40 bar sono state eseguite in un flusso dinamico diCO2, la misura a 63 bar è stata eseguita in un'atmosfera statica diCO2 in un sistema chiuso. La pressione massima di 55 bar dal serbatoio diCO2 è stata immessa nell'HP-DSC a temperatura ambiente e il sistema è stato chiuso in modo che la pressione aumentasse con il riscaldamento, raggiungendo i 63 bar all'inizio della fusione del campione. La temperatura di insorgenza estrapolata del picco di fusione del piroxicam, pari a 201,3°C a pressione ambiente, è coerente con il valore di letteratura1. L'inizio della fusione è stato ridotto di circa 5,5 K a 196°C a 40 bar diCO2. È diminuito di altri 2,5 K con una pressione diCO2 di 63 bar.
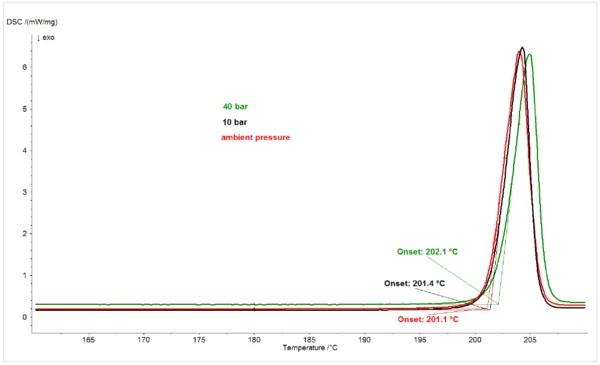
Per verificare che l'effetto di depressione del Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione del piroxicam dovuto all'aumento della pressionedella CO2 fosse specifico dellaCO2, è stato esaminato l'effetto dell'aumento della pressione dell'N2 sul comportamento di fusione del composto. La Figura 2 mostra i picchi di fusione del piroxicam sotto N2 a pressione ambiente, 10 bar e 40 bar. A differenza dell'effetto di depressione del punto di fusione dovuto all'aumento della pressionedella CO2, l'aumento della pressione dell'N2 ha causato un leggero aumento del punto di fusione del piroxicam, in linea con il comportamento della maggior parte dei materiali, che subiscono un'espansione quando passano da solidi a liquidi.
Sintesi
Le misure HP-DSC hanno mostrato che il piroxicam subisce una depressione del punto di fusione di circa 8 K in presenza di un'atmosfera diCO2 di 63 bar rispetto alla situazione a pressione ambiente. Questo studio ha dimostrato l'utilità delle misure HP-DSC per lo screening dei solidi per la potenziale depressione del punto di fusione in scCO2, anche quando le pressioni sono inferiori a quelle necessarie per raggiungere la fase supercritica.