Introdução
O estearato de magnésio é um pó branco usado como lubrificante na produção de cosméticos e produtos farmacêuticos [5]. Suas propriedades físicas podem variar de um lote para outro porque o estearato de magnésio comercial é uma mistura de diferentes sais de ácidos graxos que podem variar em proporção [4]. Além disso, suas propriedades dependem muito do teor de umidade e do estado de hidratação [1]. As propriedades variáveis do estearato de magnésio podem ser investigadas por meio de DSC, que é um método particularmente rápido e fácil para obter a impressão digital de um material. Outro método de análise térmica, o TGA, pode ser usado para indicar o estado de hidratação do estearato de magnésio puro. A seguir, uma amostra de estearato de magnésio foi caracterizada por meio de medições de DSC, TGA e PXRD (difração de raios X em pó). Além disso, foi estudada a influência nas propriedades térmicas do armazenamento por duas semanas em uma atmosfera úmida.
Condições de teste
Para o tratamento de umidade, a amostra foi armazenada em um recipiente aberto colocado acima da água de um recipiente de água selado por duas semanas. As medições foram realizadas com um DSC 214 Polyma e um TG 209 Libra® em uma atmosfera dinâmica de nitrogênio. Foram usados cadinhos selados Concavus® com tampa perfurada. As medições de PXRD foram realizadas com o Bruker D8 Advance na solid-chem GmbH.
Resultados do teste
As medidas de TGA do estearato de magnésio com e sem tratamento de umidade são mostradas nas figuras 2a e 2b (zoom da figura 2a).
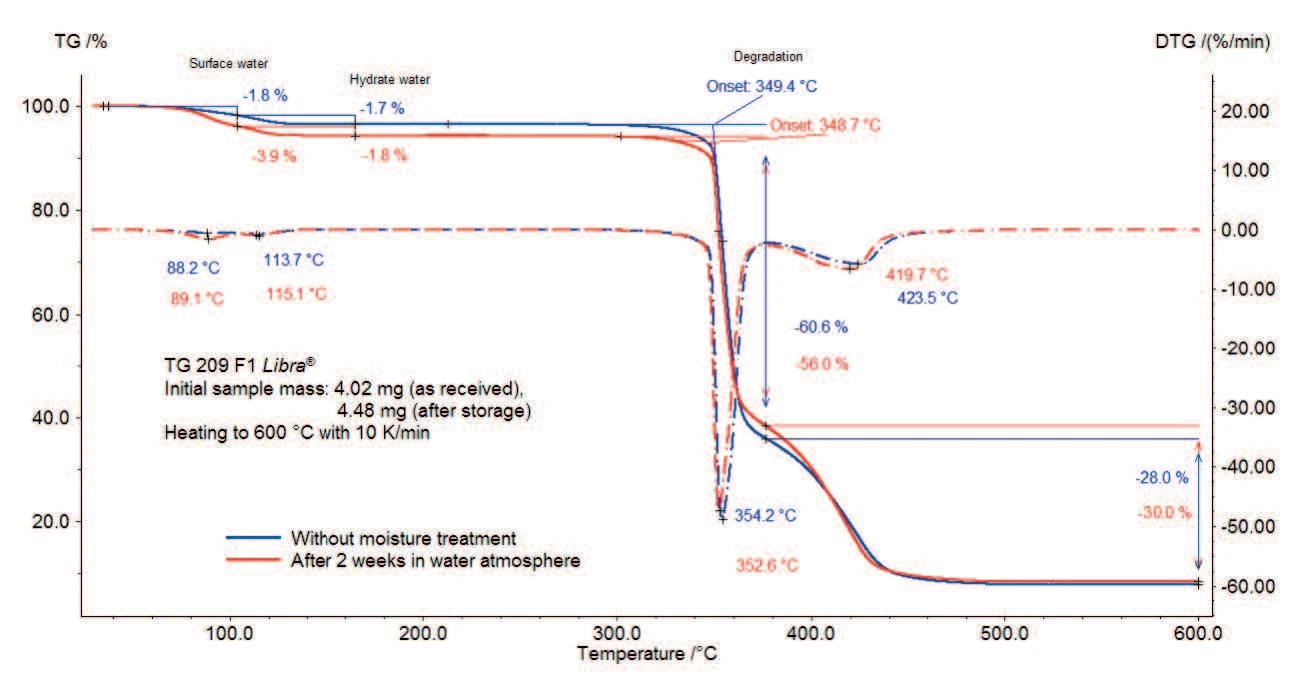
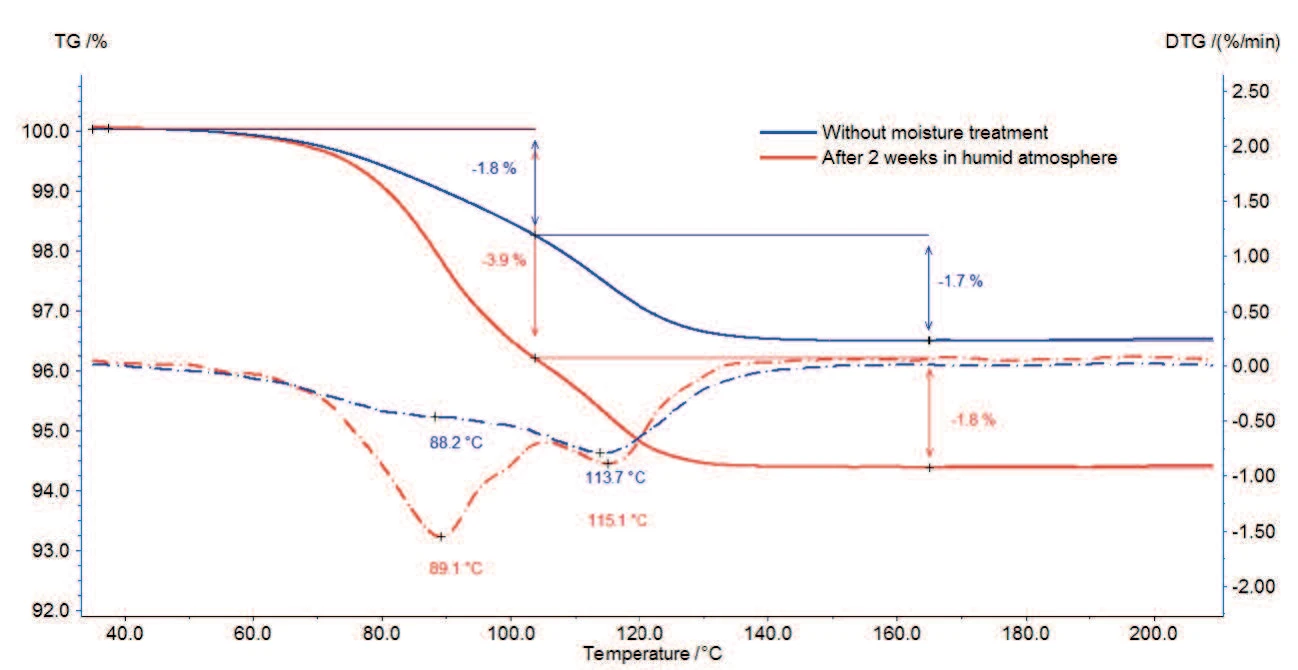
A amostra perde 3,5% de sua massa inicial entre a temperatura ambiente e 130°C (curva contínua). Pode-se observar pelos dois picos na curva da primeira derivada (DTG) nessa faixa de temperatura que esses processos são executados em duas etapas: a primeira perda de massa de 1,8% até 100 °C deve-se à evaporação da água da superfície; a segunda etapa de perda de massa é de 1,7% entre 100 °C e 130 °C e corresponde à liberação da água do hidrato.
Para a amostra testada após o armazenamento em uma atmosfera úmida, ambas as etapas também estão presentes, mas a primeira está associada a uma maior perda de massa.
De acordo com os resultados descritos em [6], a perda de massa devido à liberação da água do hidrato começa em torno de 65°C para o tri-hidrato, 85°C para o di-hidrato e 95°C para a forma mono-hidratada. Além disso, o estearato de magnésio tem uma massa molecular de 591,257 g/mol [2]. Isso resulta em uma massa molecular de 609,257 g/mol para o monoidrato, 627,257 g/mol para o diidrato e 645,257 g/mol para o triidrato. Consequentemente, a perda de água de hidratação seria de 2,95% para o monoidrato puro, 5,74% para o diidrato puro e 8,37% para o triidrato. Isso indica que a amostra sem tratamento de umidade é uma mistura de estearato de magnésio em diferentes estados de hidratação e, além disso, contém água superficial.
O armazenamento da amostra em uma atmosfera úmida leva a um aumento na primeira etapa resultante da liberação de água. De acordo com [1], o tratamento com umidade não tem influência sobre os estados de hidratação do estearato de magnésio. Consequentemente, após o tratamento com umidade, a maior perda de massa observada entre a temperatura ambiente e 130°C se origina da adsorção de água superficial ou da água absorvida na estrutura cristalina.
A Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição de ambas as amostras começa em torno de 350°C (temperaturas de início extrapoladas) e ocorre em duas etapas com uma perda de massa total de 89% (amostra sem armazenamento) e 86% (amostra após armazenamento). A brusquidão na inclinação da curva TGA entre 350°C e 370°C indica uma reação rápida durante a primeira etapa de Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição.
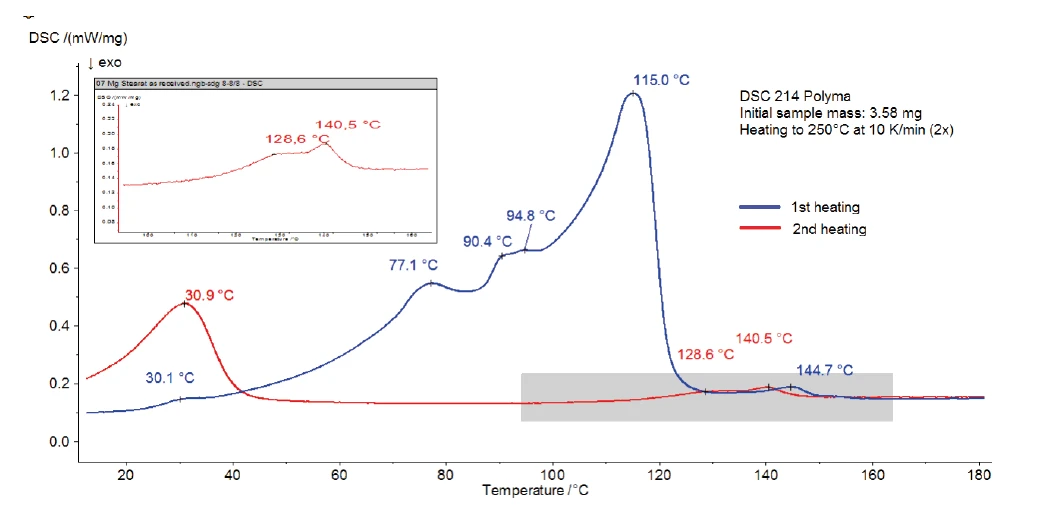
A Figura 3 mostra a medição DSC do estearato de magnésio sem tratamento com água. Um amplo efeito EndotérmicoUma transição de amostra ou uma reação é endotérmica se for necessário calor para a conversão.endotérmico com temperaturas de pico de 77°C, 90°C e 115°C é detectado entre a temperatura ambiente e 130°C. Parte dele corresponde à evaporação da água detectada na curva TGA. É possível que ele seja sobreposto pelaTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão da amostra, que também resulta em um pico EndotérmicoUma transição de amostra ou uma reação é endotérmica se for necessário calor para a conversão.endotérmico. Algumas referências indicam uma faixa deTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão entre 130°C e 145°C [3] e outras um pico deTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão a 88°C [2]. A dispersão dos dados resulta do fato de que o estearato de magnésio disponível comercialmente muitas vezes consiste em uma mistura de sais de ácidos graxos diferentes dos descritos acima. Com a variação dos componentes individuais, as propriedades da substância podem variar de lote para lote [4].
O segundo aquecimento (curva vermelha) mostra que apenas o pico a 31°C e o efeito EndotérmicoUma transição de amostra ou uma reação é endotérmica se for necessário calor para a conversão.endotérmico na faixa de temperatura entre 120°C e 150°C permanecem após o primeiro aquecimento. Isso indica um processo reversível, como aTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão de constituintes. Devido à aplicação de uma tampa perfurada, a água (adsorvida e quimicamente ligada) não está mais presente no interior da amostra a essa temperatura. Portanto, é possível que os picos a 145°C (1º aquecimento) ou 141°C (2º aquecimento) estejam relacionados à faixa deTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão do estearato de magnésio sem água.
A Figura 4 mostra as curvas DSC (1º e 2º aquecimento) do estearato de magnésio após o armazenamento em uma atmosfera úmida. Em comparação com a figura 3, o impacto do tratamento com umidade pode ser facilmente observado. Ele tem uma forte influência sobre os efeitos endotérmicos detectados no primeiro aquecimento entre a temperatura ambiente e 130°C, associados a diferenças nas propriedades físicas, conforme indicado na literatura [1].
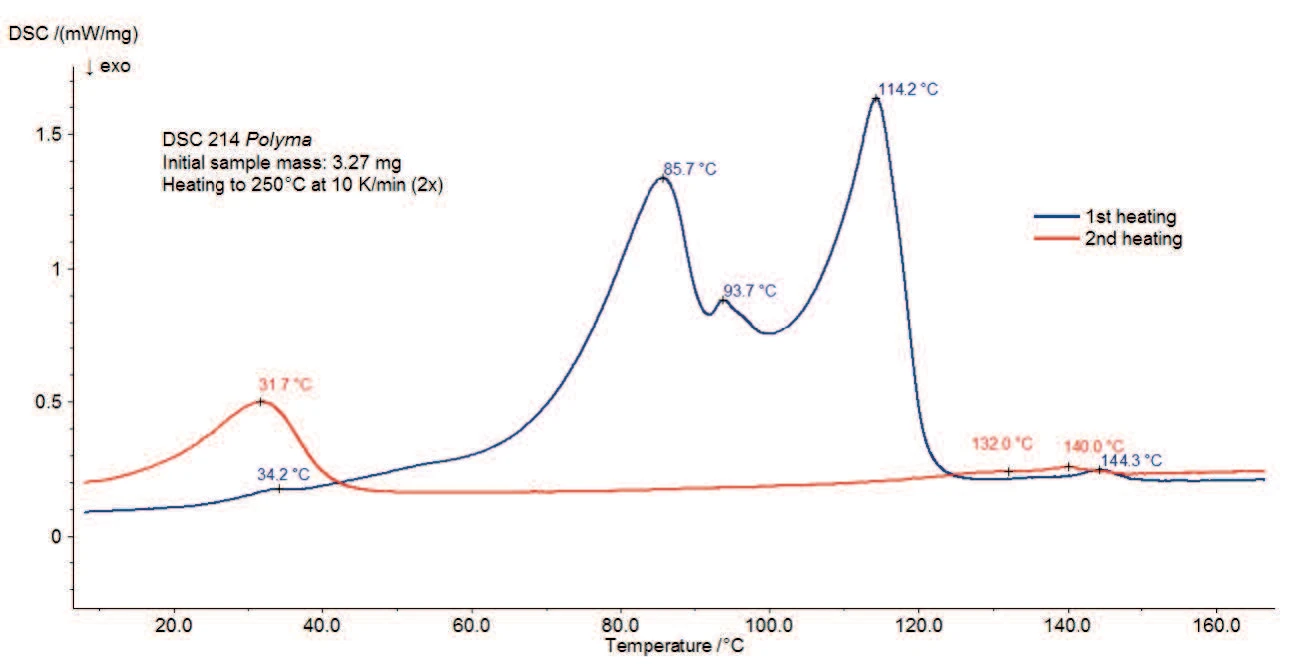
No entanto, o segundo aquecimento é muito semelhante ao da amostra original. Após o aquecimento a 250°C e o resfriamento controlado em uma atmosfera seca, ambas as amostras atingem o mesmo estado. Os picos detectados são devidos à fusão dos constituintes.
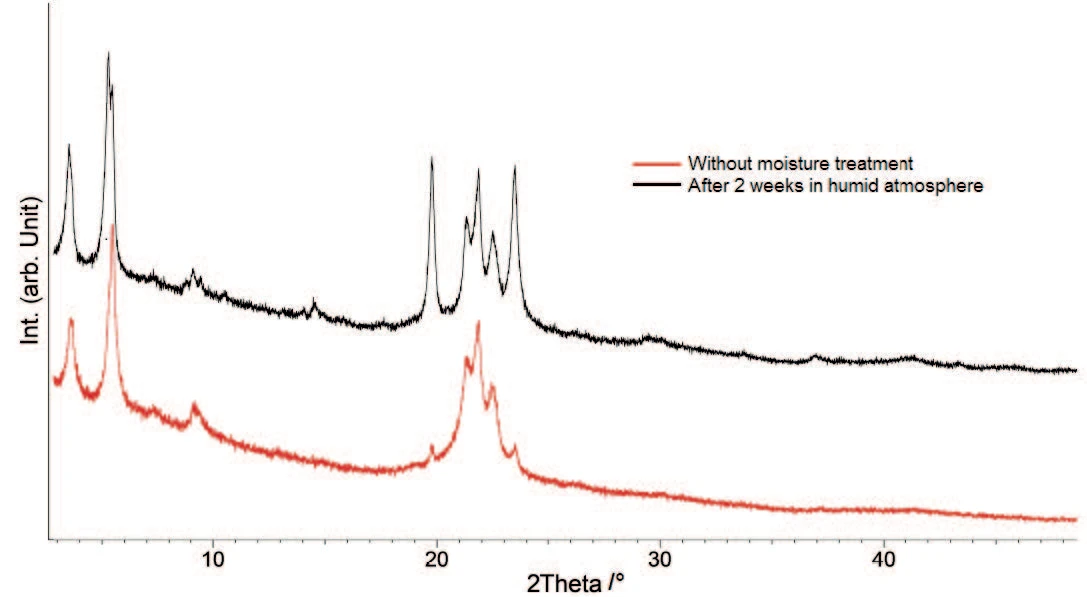
Para poder caracterizar melhor os componentes individuais, foram realizadas medições de difração de raios X (PXRD) em ambas as amostras - original e tratada com água (figura 5).
Os padrões de PXRD diferem claramente para os picos em aproximadamente 20° e 23,5° 2θ. Eles estão presentes em ambas as amostras, mas suas intensidades aumentam com o tratamento de umidade. Isso significa que um hidrato, que já estava presente na amostra original, é cada vez mais formado durante o armazenamento em uma atmosfera úmida. A comparação do padrão de raios X com os dados da literatura [6] confirma o tri-hidrato, concentrando-se nos picos a 20° e 23,5° 2θ.
As formas de hidrato são estáveis na presença de umidade [1], de modo que o tri-hidrato é formado a partir de um anidrato presente na amostra original. Esse resultado confirma a avaliação de LV Allen e PE Luner [7] de que a forma anidra do estearato de magnésio se reidrata para formar um tri-hidrato em umidade relativa superior a 50%.
Conclusão
As medições de DSC e TGA foram realizadas no estearato de magnésio com e sem armazenamento em uma atmosfera úmida. O tratamento com água permitiu o aumento da água superficial e da água cristalina.
Esse conhecimento é ainda mais importante porque há uma correlação entre o tratamento de umidade e as propriedades físicas do estearato de magnésio [1]; portanto, é fundamental realizar verificações no produto antes do processamento. Para isso, a DSC e a TGA são ferramentas úteis que permitem a rápida caracterização e/ou comparação das diferentes lots.
Agradecimento
NETZSCH gostaria de agradecer à solid-chem GmbH em Bochum, Alemanha, por realizar as medições e a avaliação de PXRD.