Introduzione
Lo stearato di magnesio è una polvere bianca utilizzata come lubrificante nella produzione di cosmetici e prodotti farmaceutici [5]. Le sue proprietà fisiche possono variare da un lotto all'altro perché lo stearato di magnesio commerciale è una miscela di diversi sali di acidi grassi che possono variare in proporzione [4]. Inoltre, le sue proprietà dipendono fortemente dal contenuto di umidità e dallo stato di idratazione [1]. Le diverse proprietà dello stearato di magnesio possono essere studiate mediante DSC, un metodo particolarmente rapido e semplice per ottenere l'impronta digitale di un materiale. Un altro metodo di analisi termica, la TGA, può essere utilizzato per indicare lo stato di idratazione dello stearato di magnesio puro. Di seguito, un campione di stearato di magnesio è stato caratterizzato mediante misure DSC, TGA e PXRD (diffrazione di raggi X in polvere). Inoltre, è stata studiata l'influenza sulle proprietà termiche dello stoccaggio per due settimane in atmosfera umida.
Condizioni di prova
Per il trattamento dell'umidità, il campione è stato conservato per due settimane in un contenitore aperto posto sopra l'acqua di un recipiente sigillato. Le misure sono state effettuate con un DSC 214 Polyma e un TG 209 Libra® in atmosfera dinamica di azoto. Sono stati utilizzati crogioli sigillati Concavus® con coperchio forato. Le misure PXRD sono state eseguite con il Bruker D8 Advance presso solid-chem GmbH.
Risultati del test
Le misure TGA dello stearato di magnesio con e senza trattamento con umidità sono rappresentate nelle figure 2a e 2b (zoom della figura 2a).
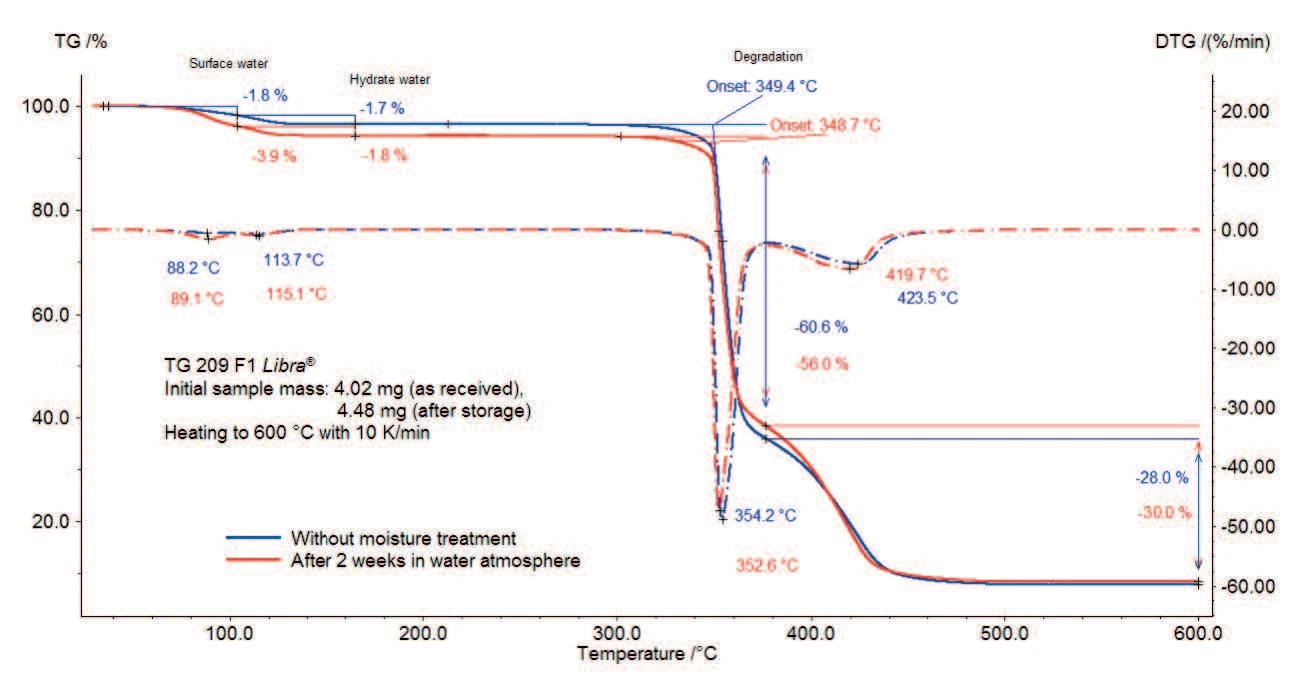
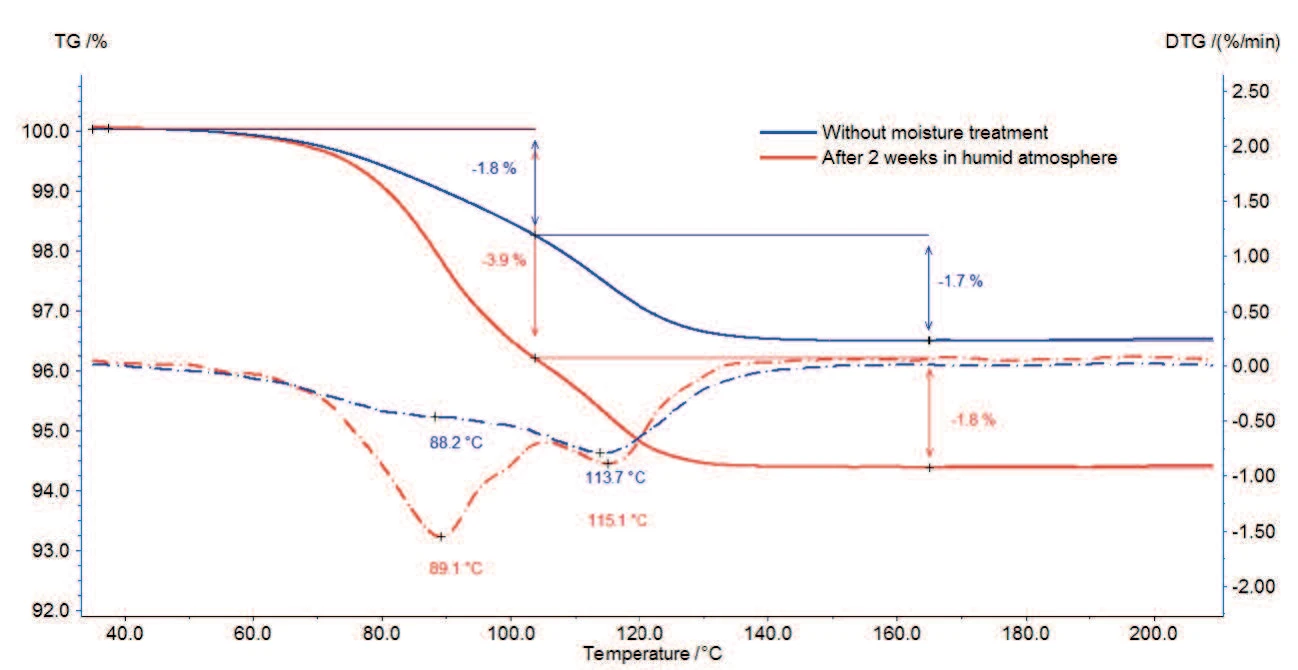
Il campione perde il 3,5% della sua massa iniziale tra la temperatura ambiente e i 130°C (curva continua). Dai due picchi della curva delle derivate prime (DTG) in questo intervallo di temperatura si evince che questi processi avvengono in due fasi: la prima perdita di massa dell'1,8% fino a 100°C è dovuta all'evaporazione dell'acqua superficiale; la seconda fase di perdita di massa ammonta all'1,7% tra 100°C e 130°C e corrisponde al rilascio di acqua idrata.
Anche per il campione testato dopo lo stoccaggio in atmosfera umida sono presenti entrambe le fasi, ma la prima è associata a una perdita di massa maggiore.
Secondo i risultati descritti in [6], la perdita di massa dovuta al rilascio dell'acqua idrata inizia intorno ai 65°C per il triidrato, 85°C per il diidrato e 95°C per la forma monoidrata. Inoltre, lo stearato di magnesio ha una massa molecolare di 591,257 g/mol [2]. Ne consegue una massa molecolare di 609,257 g/mol per il monoidrato, 627,257 g/mol per il diidrato e 645,257 g/mol per il triidrato. Di conseguenza, la perdita di acqua di idratazione sarebbe del 2,95% per il monoidrato puro, del 5,74% per il diidrato puro e dell'8,37% per il triidrato. Ciò indica che il campione senza trattamento con umidità è una miscela di stearato di magnesio a diversi stati di idratazione e contiene inoltre acqua di superficie.
La conservazione del campione in un'atmosfera umida porta a un aumento della prima fase derivante dal rilascio di acqua. Secondo [1], il trattamento con umidità non ha alcuna influenza sugli stati di idratazione dello stearato di magnesio. Di conseguenza, dopo il trattamento con umidità, la maggiore perdita di massa osservata tra la temperatura ambiente e i 130°C è dovuta all'adsorbimento di acqua superficiale o all'acqua assorbita nella struttura cristallina.
La Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione di entrambi i campioni inizia intorno ai 350°C (temperature di insorgenza estrapolate) e si svolge in due fasi con una perdita di massa totale dell'89% (campione senza stoccaggio) e dell'86% (campione dopo lo stoccaggio). La bruschezza della pendenza della curva TGA tra 350°C e 370°C indica una reazione rapida durante la prima fase di Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione.
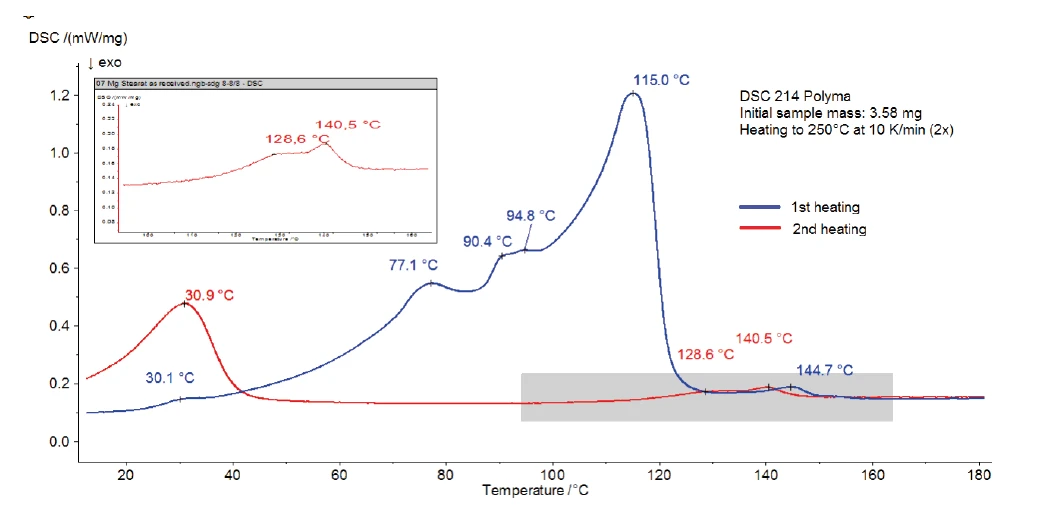
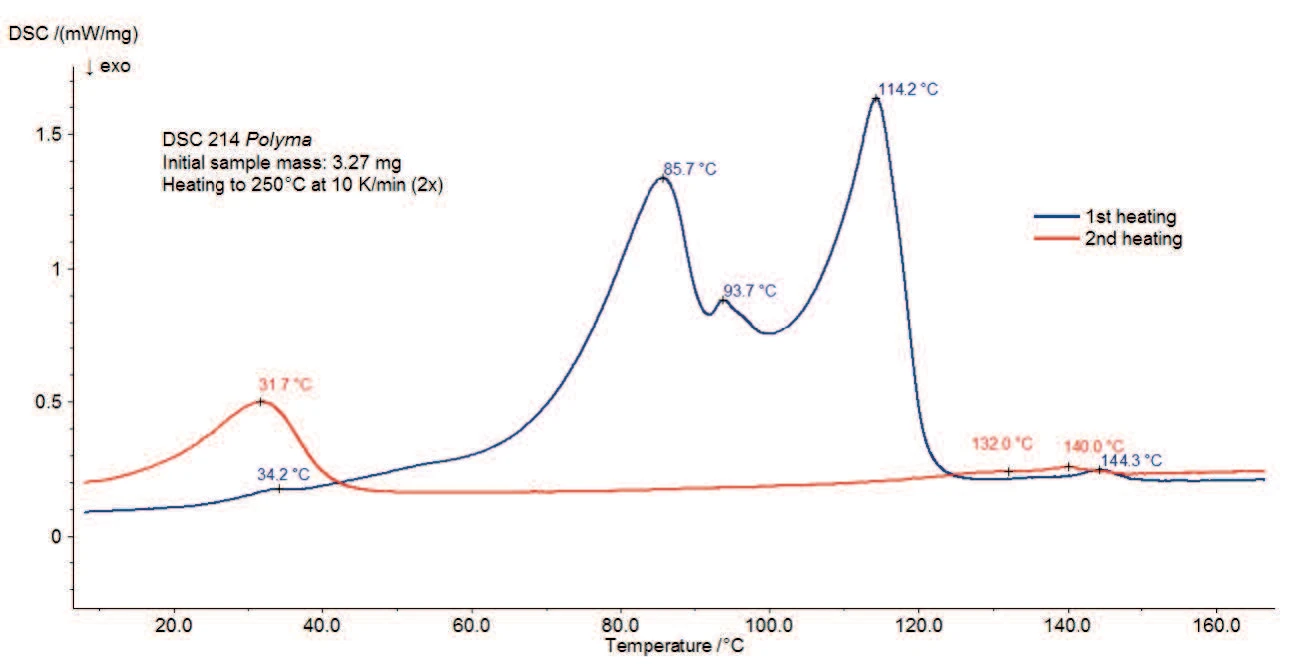
La Figura 3 mostra la misurazione DSC dello stearato di magnesio senza trattamento con acqua. Tra la temperatura ambiente e i 130°C viene rilevato un ampio effetto EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico con picchi di temperatura a 77°C, 90°C e 115°C. Parte di esso corrisponde all'evaporazione dell'acqua rilevata nella curva TGA. È possibile che si sovrapponga allaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione del campione, che determina anch'essa un picco EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico. Alcuni riferimenti indicano un intervallo diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione tra 130°C e 145°C [3] e altri un picco diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione a 88°C [2]. La dispersione dei dati deriva dal fatto che lo stearato di magnesio disponibile in commercio è spesso costituito da una miscela di sali di acidi grassi diversi da quelli descritti sopra. Con la variazione dei singoli componenti, le proprietà della sostanza possono variare da lotto a lotto [4].
Il secondo riscaldamento (curva rossa) mostra che, dopo il primo riscaldamento, rimangono solo il picco a 31°C e l'effetto EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico nell'intervallo di temperatura compreso tra 120°C e 150°C. Ciò indica un processo reversibile, come ad esempio il riscaldamento di un'unità di misura. Ciò indica un processo reversibile, come laTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione dei costituenti. A causa dell'applicazione di un coperchio forato, l'acqua (sia adsorbita che legata chimicamente) non è più presente all'interno del campione a questa temperatura. Pertanto, è possibile che i picchi a 145°C (1° riscaldamento) o 141°C (2° riscaldamento) siano legati all'intervallo diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione dello stearato di magnesio privo di acqua.
La Figura 4 mostra le curve DSC (1° e 2° riscaldamento) dello stearato di magnesio dopo lo stoccaggio in atmosfera umida. Rispetto alla figura 3, si può facilmente osservare l'impatto del trattamento con umidità. Essa ha una forte influenza sugli effetti endotermici rilevati nel primo riscaldamento tra la temperatura ambiente e i 130°C, associati a differenze nelle proprietà fisiche come indicato in letteratura [1].
Tuttavia, il secondo riscaldamento è molto simile a quello del campione originale. Dopo il riscaldamento a 250°C e il raffreddamento controllato in atmosfera secca, entrambi i campioni raggiungono lo stesso stato. I picchi rilevati sono dovuti alla fusione dei costituenti.
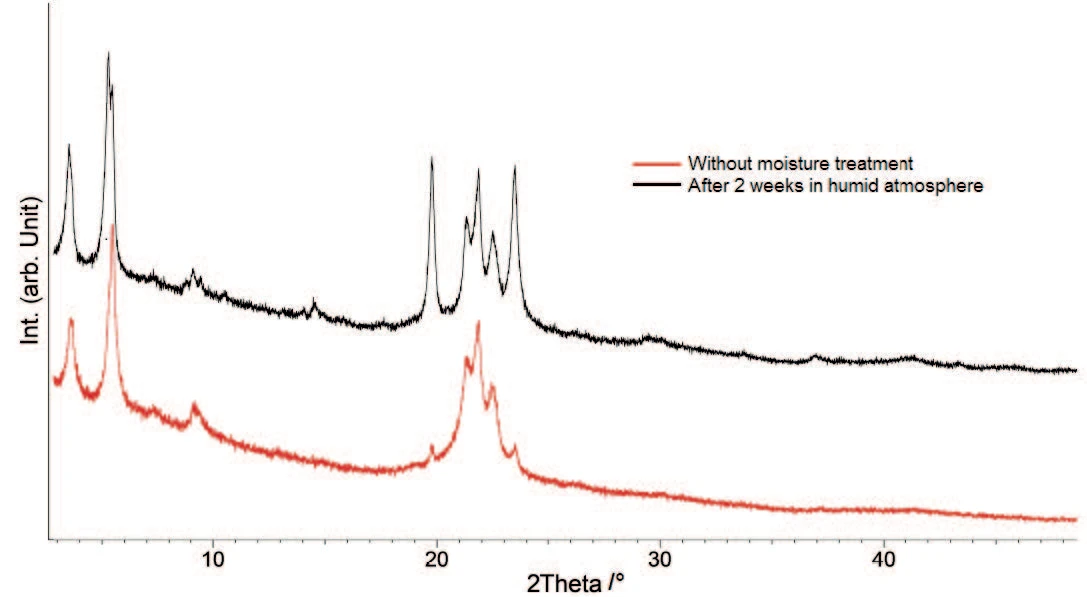
Per poter caratterizzare meglio i singoli componenti, sono state effettuate misure di diffrazione di raggi X (PXRD) su entrambi i campioni, originale e trattato con acqua (figura 5).
I pattern PXRD differiscono chiaramente per i picchi a circa 20° e 23,5° 2θ. Sono presenti in entrambi i campioni, ma la loro intensità aumenta con il trattamento con acqua. Ciò significa che un idrato, già presente nel campione originale, si forma sempre più durante lo stoccaggio in atmosfera umida. Il confronto del pattern di raggi X con i dati di letteratura [6] conferma la triidratazione, concentrandosi sui picchi a 20° e 23,5° 2θ.
Le forme idrate sono stabili in presenza di umidità [1], quindi il triidrato si forma da un anidrato presente nel campione originale. Questo risultato conferma la valutazione di LV Allen e PE Luner [7], secondo cui la forma anidra dello stearato di magnesio si reidrata per formare un triidrato con un'umidità relativa superiore al 50%.
Conclusione
Le misure DSC e TGA sono state effettuate sullo stearato di magnesio con e senza stoccaggio in atmosfera umida. Il trattamento con acqua ha permesso di aumentare sia l'acqua superficiale che l'acqua cristallina.
Questa conoscenza è tanto più importante in quanto esiste una correlazione tra il trattamento con umidità e le proprietà fisiche dello stearato di magnesio [1]; pertanto, è fondamentale effettuare controlli sul prodotto prima della lavorazione. A tal fine, DSC e TGA sono strumenti utili che consentono una rapida caratterizzazione e/o confronto dei diversi lots.
Riconoscimento
NETZSCH si ringrazia la solid-chem GmbH di Bochum, Germania, per aver effettuato le misurazioni e la valutazione PXRD.