Einleitung
Magnesiumstearat ist ein weißes Pulver, das als Schmierstoff in der Herstellung von Kosmetika und Pharmazeutika eingesetzt wird [5]. Die physikalischen Eigenschaften können von Charge zu Charge variieren, denn handelsübliches Magnesiumstearat ist eine Mischung aus unterschiedlichen Fettsäuresalzen mit variierenden Proportionen [4]. Desweiteren sind die Eigenschaften stark abhängig vom Feuchtegehalt und Hydratisierungsgrad [1]. Die Unterschiede in den Eigenschaften von Magnesiumstearat können mittels DSC untersucht werden, die eine schnelle und einfache Methode zum Erhalt eines Fingerabdruckes von der Substanz darstellt. Als weitere thermoanalytische Methode gibt die Thermogravimetrie (TG) Aufschlüsse über die Hydratation von Magnesiumstearat. Hier wurde eine Magnesiumstearat-Probe mittels DSC, TG und PXRD (Röntgen-Pulverdiffraktometrie nach dem Debye-Scherrer-Verfahren) gemessen. Zusätzlich wurde der Einfluss einer zweiwöchigen Lagerung in feuchter Atmosphäre auf die thermischen Eigenschaften untersucht.
Messbedingungen
Für die Feuchtebehandlung wurde die Probe zwei Wochen in einem offenen Container über dem Wasser eines geschlossenen Wasserbehälters gelagert. Die Messungen wurden mit der DSC 214 Polyma und TG 209 Libra® in dynamischer Stickstoffatmosphäre in Concavus®-Tiegeln mit gelochtem Deckel durchgeführt. Die PXRD-Messungen erfolgten mit dem Röntgendiffraktometer D8 Adance von Bruker bei der solid-chem GmbH.
Messergebnisse
Die TG-Messergebnisse an Magnesiumstearat vor und nach der Feuchtebehandlung sind in den Abbildungen 2a und 2b (Zoom von Abbildung 2a) dargestellt.
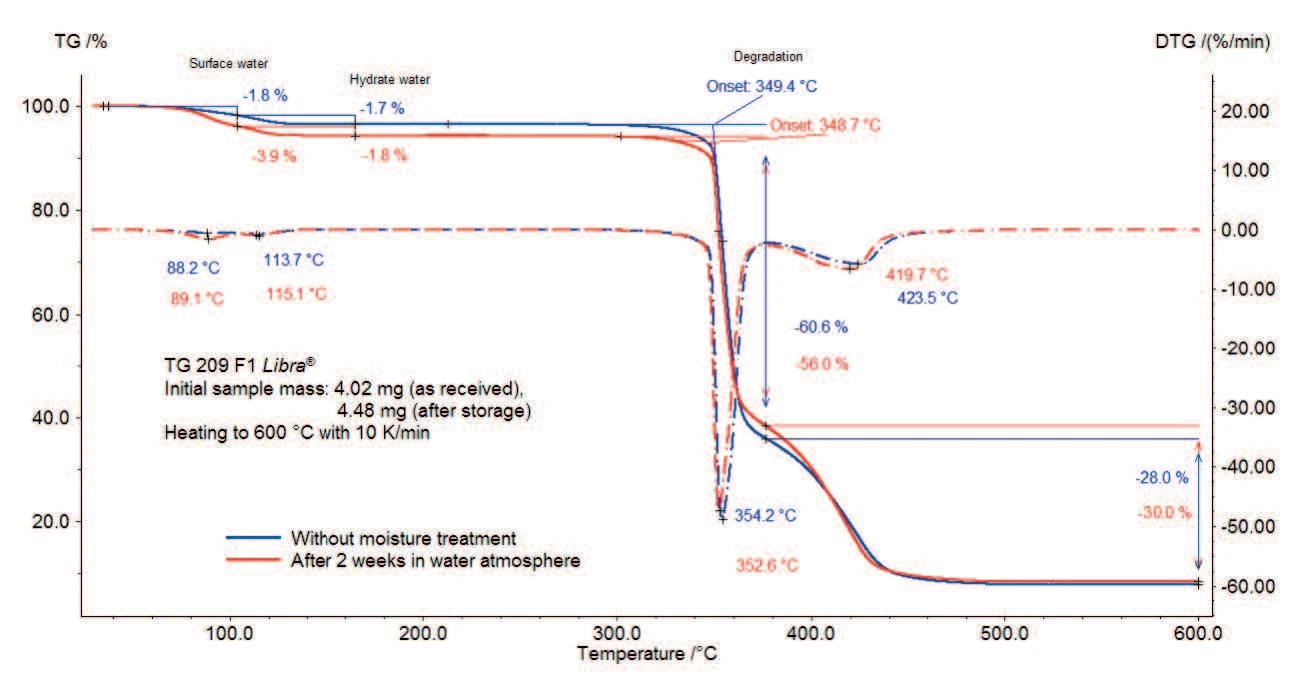
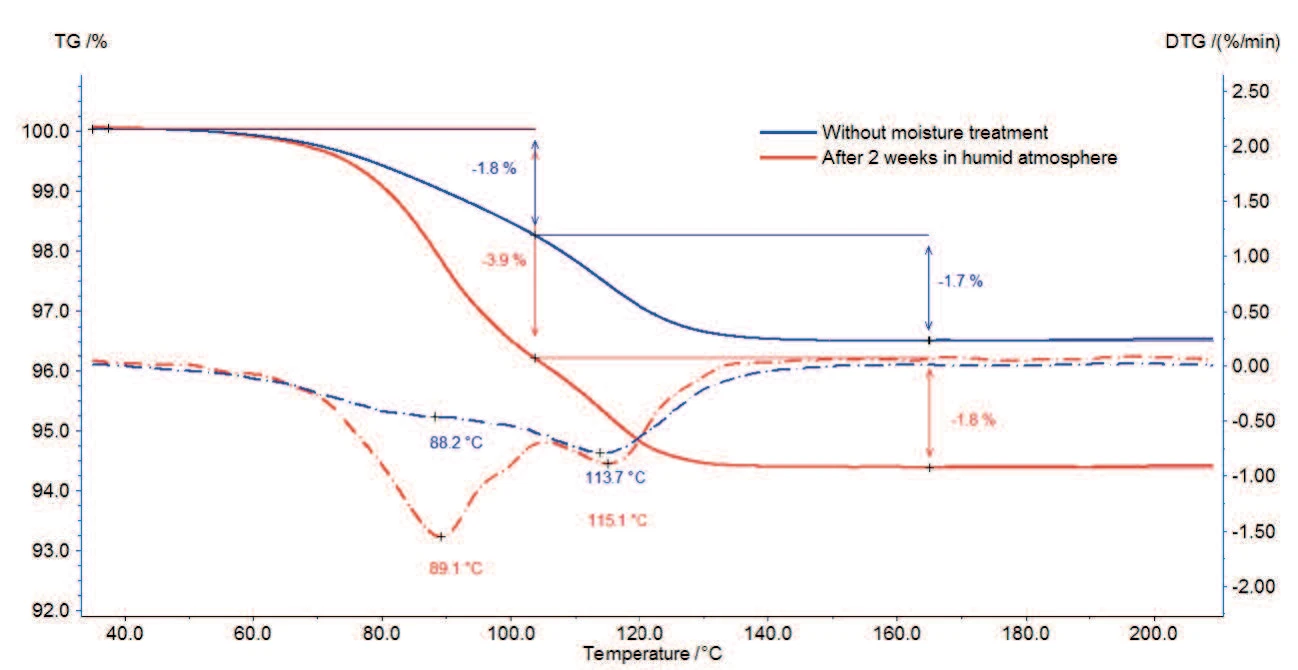
Die Probe ohne Feuchtebehandlung (blaue Kurve) verliert zwischen Raumtemperatur und 130 °C 3,5 % ihrer ursprünglichen Masse. Wie aus den beiden Peaks in der ersten Ableitungskurve (DTG) in diesem Temperaturbereich ersichtlich ist, verläuft dieser Prozess in zwei Schritten: Der erste Massenverlust von 1,8 % bei 100 °C ist auf die Freisetzung von Oberflächenwasser zurückzuführen; die zweite Massenverluststufe zwischen 100 °C und 130 °C beträgt 1,7 % und entspricht der Freisetzung von Hydratwasser.
Auch bei der Probe nach Lagerung in feuchter Atmosphäre (rote Kurve) treten beide Stufen auf, jedoch ist die erste mit einem höheren Massenverlust verbunden.
Gemäß der in [6] beschriebenen Ergebnisse setzt der auf die Freisetzung von Hydratwasser zurückzuführende Massenverlust bei ca. 65 °C für die Trihydrat-, bei 85 °C für die Dihydrat- und und bei 95 °C für die Monohydratform ein. Desweiteren weist Magnesiumstearate eine Molmasse von 591,257 g/mol [2] auf. Dies führt zu einer Molmasse von 609,257 g/mol für das Monohydrat, 627,257 g/mol für das Dihydrat und 645,257 g/mol für das Trihydrat. Folglich würde der Verlust von Hydratwasser bei 2,95 % für das reine Monohydrat, 5,74 % für das reine Dihydrat und 8,37 % für das Trihydrat betragen.
Dies ist ein Anzeichen dafür, dass die Probe ohne Feuchtebehandlung eine Mischung aus Magnesiumstearat mit unterschiedlichen Hydratation ist und zusätzlich noch Oberflächenwasser beinhaltet. Die Lagerung der Probe in feuchter Atmosphäre hat einen Anstieg der ersten Stufe aufgrund der Wasserfreisetzung zur Folge. Gemäß [1] hat die Feuchtebehandlung keinen Einfluss auf die Hydratation von Magnesiumstearat. Infolgedessen ist der zwischen Raumtemperatur und 130 °C beobachtete höhere Massenverlust auf die Adsorption von Oberflächenwasser oder von in der Kristallstruktur absorbiertem Wasser.
Die Zersetzung beider Proben beginnt bei ca. 350 °C (extrapolatierte Onsettemperaturen) und verläuft in zwei Stufen mit einem gesamten Massenverlust von 89 % (Probe ohne Lagerung) bzw. 86 % (Probe nach Lagerung). Der abrupte Abfall in der TG-Kurve zwischen 350 °C und 270 °C zeigt eine schnelle Reaktion während der ersten Zersetzungsstufe.
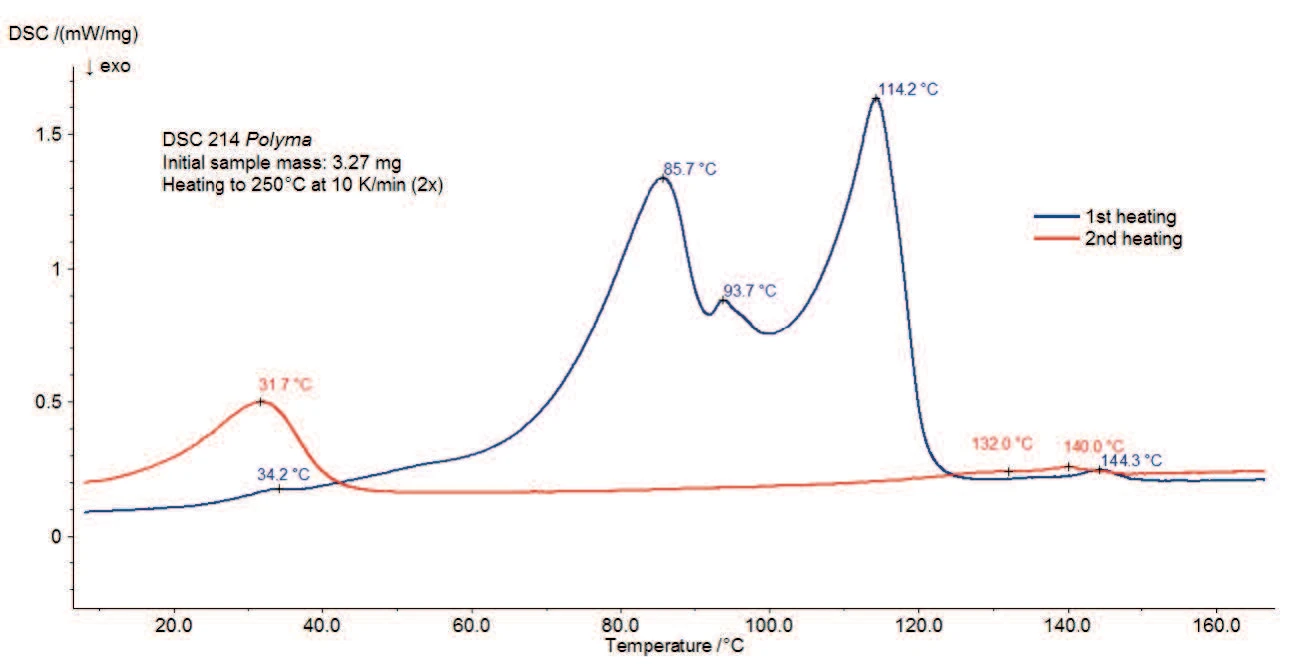
Abbildung 3 zeigt die DSC-Messungen an Magnesiumstearat ohne Wasserbehandlung. Ein breiter endothermer Effekt mit Peaktemperaturen bei 77 °C, 90 °C und 115 °C wurde zwischen Raumtemperatur und 130 °C detektiert, der teilweise mit der in der TG-Kurve detektierten Freisetzung von Wasser (Abbildung 2a) übereinstimmt. Möglicherweise ist dieser vom Schmelzen der Probe überlagert, was ebenfalls zu einem endothermen Peak führt. Einige Referenzen zeigen einen Schmelzbereich zwischen 130 °C und 145 °C [3] und andere einen Schmelzpeak bei 88 °C [2]. Die Streuung der Daten ist darauf begründet, dass handelsübliches Magnesiumstearat, wie vorher bereits beschrieben, oftmals aus einer Mischung unterschiedlicher Fettsäuresalzen besteht. Mit Variation der individuellen Komponenten können sich die Eigenschaften der Substanz von Charge zu Charge ändern [4].
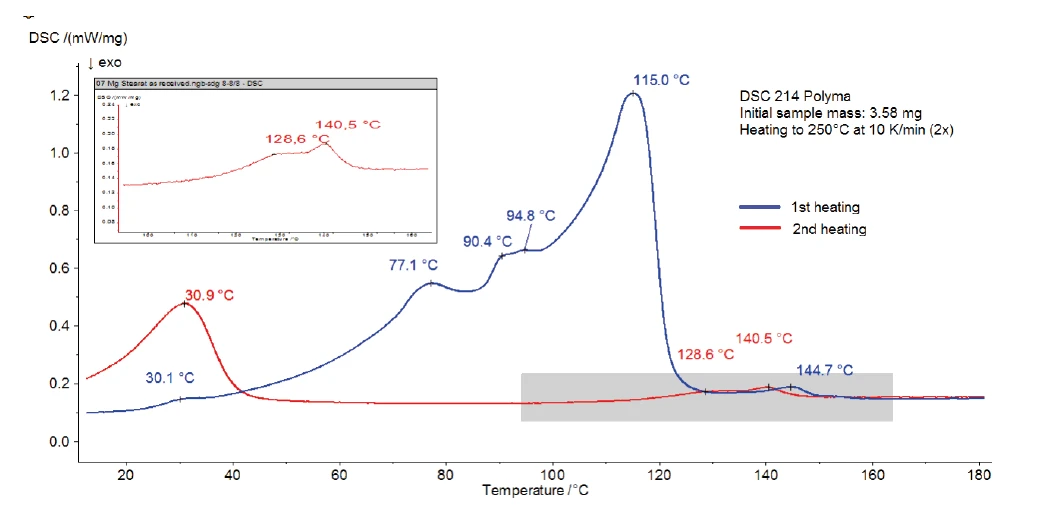
Wie der zweiten Aufheizung (rote Kurve) entnommen werden kann, verbleiben nach der ersten Aufheizung nur der Peak bei 31 °C sowie der endotherme Effekt im Temperaturbereich zwischen 120 °C und 150 °C. Dies ist ein Anzeichen für einen reversiblen Vorgang, wie zum Beispiel das Schmelzen von Komponenten. Bei Verwendung eines gelochten Deckels tritt kein Wasser (sowohl adsorbiertes als auch chemisch gebundenes) mehr bei dieser Temperatur in der Probe auf. Daher ist es möglich, dass sich die Peaks bei 145 °C (1. Aufheizung) oder 141 °C (2. Aufheizung) auf den Schmelzbereich von wasserfreiem Magnesiumstearat beziehen. Abbildung 4 zeigt die DSC-Kurven (1. und 2. Aufheizungen) von Magnesiumstearat nach Lagerung in feuchter Atmosphäre. Im Vergleich zu Abbildung 3 ist der Einfluss der Feuchtebehandlung eindeutig zu erkennen. Sie hat einen starken Einfluss auf die endothermen Effekte in der ersten Aufheizung zwischen Raumtemperatur und 130°C, verbunden mit den in der Literatur [1] genannten Unterschieden in den physikalischen Eigenschaften.
Die zweite Aufheizung ist jedoch der der ursprünglichen Probe sehr ähnlich. Nach Aufheizung bis 250 °C und geregelter Abkühlung in trockener Atmosphäre erreichen beide Proben den gleichen Zustand. Die detektierten Peaks sind auf das Schmelzen von Komponenten zurückzuführen.
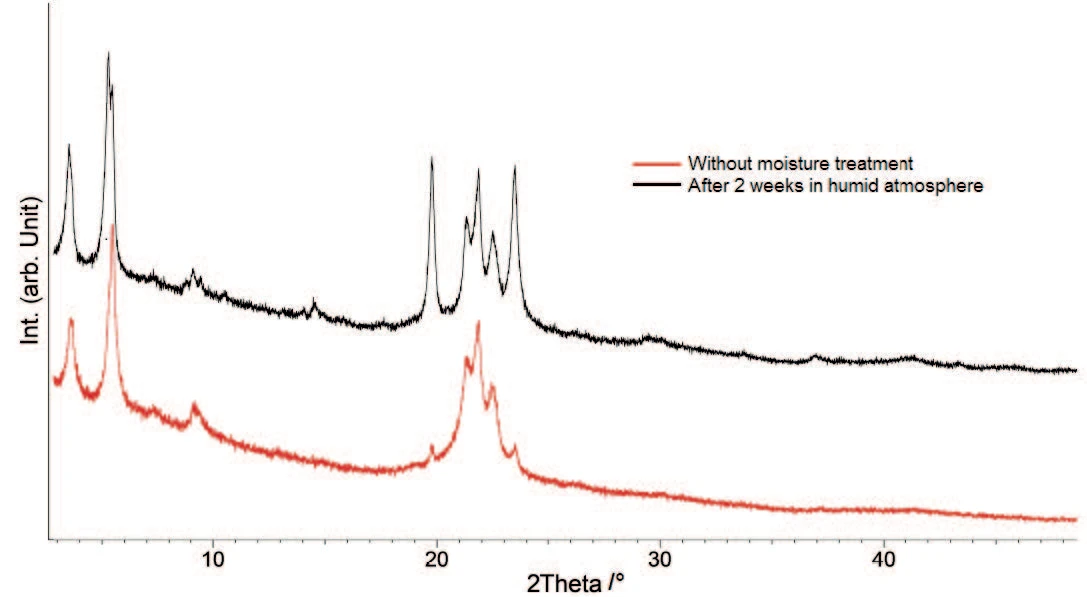
Für eine bessere Charakterisierung der individuellen Komponenten wurden Röntgenbeugungs-Messungen (PXRD) an beiden Proben durchgeführt – an den Originalproben und den Proben nach einer Wasserbehandlung (Abbildung 5).
Die PXRD-Muster unterscheiden sich sehr deutlich für die Peaks bei ca. 20° und 23,5° 2θ. Sie sind zwar in beiden Proben vorhanden, jedoch steigt ihre Intensität mit der Feuchtebehandlung an. Dies bedeutet, dass ein Hydrat, das in der ursprünglichen Probe bereits vorhanden war, während der Lagerung in feuchter Atmosphäre verstärkt gebildet wird. Der Vergleich der Röntgenbeugungsmuster mit Literaturdaten [6] bestätigt das Trihydrat mit Hauptaugenmerk auf die Peaks bei 20° und 23,5 ° 2θ.
Die Hydratformen sind in Gegenwart von Feuchtigkeit stabil [1], so dass das Triyhdrat aus einem in der ursprünglichen Probe vorhandenen Anhydrat gebildet wird. Dieses Ergebnis bestätigt die Annahme von LV Allen und PE Luner [7], dass die Anhydrat-Form von Magnesiumstearat bei relativer Luftfeuchte höher als 50 % rehydriert, um ein Trihydrat zu bilden.
Zusammenfassung
Die DSC- und TG-Messungen an Magnesiumstearat wurden vor und nach Lagerung in feuchter Atmosphäre durchgeführt. Durch die Wasserbehandlung sind sowohl das Oberflächen- als auch das Kristallwasser angestiegen.
Dieses Wissen ist umso wichtiger, da es zwischen der Feuchtebehandlung und den physikalischen Eigenschaften von Magnesiumstearat [1] einen Zusammenhang gibt; somit ist die Eingangskontrolle vor dem Verarbeitungsprozess entscheidend. Für diese Zwecke stellen die DSC und TG hilfreiche Werkzeuge für die schnelle Charakterisierung unterschiedlicher Chargen und/oder deren Vergleich dar.
Danksagung
Wir danken der solid-chem GmbH, Bochum, für die Durchführung und Auswertung der PXRD-Messungen.