مقدمة
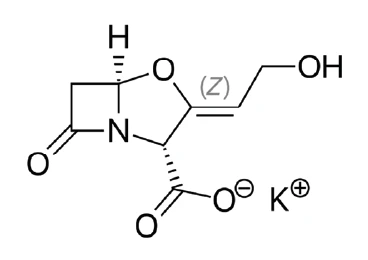
كلافولانات البوتاسيوم (الشكل 1) هو أحد أملاح حمض الكلافولانيك وهو مضاد حيوي رئيسي من مضادات حيوية بيتا لاكتام التي ينتجها كائن ستربتوميسيس كلافوليجروس [1]. وهو في الواقع قادر بمفرده على القيام بنشاط مضاد للجراثيم ضعيف فقط ضد معظم الكائنات الحية، ولكن مع المضاد الحيوي أموكسيسيلين، يكون فعالاً ضد البكتيريا المنتجة لـß-lactamas المنتجة للمكورات العنقودية المقاومة للأموكسيسيلين وحده [2، 3]. وهذا هو السبب في أنه مادة راسخة في صناعة الأدوية.
يُظهر أموكسيسيلين وكلافولانات البوتاسيوم مسارات تحلل متشابهة. ومع ذلك، يعتمد ثبات مزيج أموكسيسيلين وكلافولانات البوتاسيوم بشكل أساسي على الكلافولانات التي تعد الأكثر قابلية للتحلل من الاثنين [4، 5].
وقد تم دراسة تحلل كلافولانات البوتاسيوم في العديد من الأبحاث [3، 4، 7، 12]. بشكل عام، تمت دراسة المادة في محاليل ذات مستويات مختلفة من الأس الهيدروجيني وفي وجود الأموكسيسيلين. لوحظ أن ثبات الخليط أموكسيسيلين/حمض الكلافولانيك يتأثر بزيادة درجة الحرارة من 25 درجة مئوية إلى 40 درجة مئوية [3]. من ناحية أخرى، يزداد العمر الافتراضي للخليط بشكل كبير إذا تم تحمض الأس الهيدروجيني للمحلول [4]. كما لوحظ أيضًا أنه في المحاليل، يتم تحفيز تحلل حمض الكلافولانيك في المحاليل بواسطة نواتج التحلل المائي [12]. كما هو موضح باستخدام طريقة HPLC على العينات المخزنة في درجات حرارة مختلفة وتحت ظروف جوية مختلفة، فإن تحلل كلافولانات البوتاسيوم في الحالة الصلبة يتبع آلية أخرى: نواتج التحلل المتكونة في الحالة الصلبة ليس لها أي تأثير تحفيزي [8].
يمكن أيضًا استكشاف الاستقرار الحراري باستخدام قياس الثبات الحراري الذي يحدد، من بين أمور أخرى، درجة الحرارة التي تبدأ عندها المادة في التحلل أو التفاعل [9]. تم توصيف التحلل الحراري لكلافولانات البوتاسيوم الصلبة عن طريق ميزان حراري مقترن بمطياف FT-IR في [13]. في ما يلي، تُستخدم قياسات قياس الثقل الحراري لإجراء دراسات حركية لتفاعل التحلل.
يسمح ذلك بالتنبؤ بتحلل كلافولانات البوتاسيوم في ظروف درجة حرارة ووقت محددين. تسمح معرفة الثبات الحراري وفهم عملية تحلل كلافولانات البوتاسيوم في الحالة الصلبة بتحسين ظروف تخزينه.
تجريبي
تم إجراء قياسات TGA باستخدام ميزان NETZSCH TG 209 F1 Libra® الحراري المزود بمغير العينة الأوتوماتيكي. من قياس TGA-FT-الأشعة تحت الحمراء الموصوف في [13]، علمنا أن العينة تطلق الماء السطحي بمجرد بدء القياس. لهذا السبب، تم إجراء القياسات التالية باستخدام بوتقات الألومنيوم المغلقة. قبل القياس مباشرة، تم ثقب غطاء البوتقة تلقائيًا بواسطة جهاز الثقب الخاص بجهاز القياس بالأشعة تحت الحمراء. وهذا يمنع العينة من إطلاق الماء السطحي بالفعل قبل بدء القياس الفعلي، وهو ما من شأنه أن يزيف قيمة الكتلة الأولية.
كانت كتل العينة بين 4.33 و5.04 مجم. وسُخِّنت العينات بين درجة حرارة الغرفة و600 درجة مئوية بأربعة معدلات تسخين تتراوح بين 1 كلفن/دقيقة و10 كلفن/دقيقة. أُجريت القياسات في جو نيتروجين ديناميكي (40 مل/دقيقة).
كانت منحنيات TGA التي تم الحصول عليها هي الأساس للتقييم الحركي لتفاعل التحلل.
ولهذا الغرض، تم استخدام برنامج Kinetics Neo (من شركة NETZSCH-Gerätebau GmbH). يسمح هذا البرنامج بنمذجة حركية التفاعلات من خطوة واحدة إلى تفاعلات متعددة الخطوات.
يمكن لهذا البرنامج تعيين كل خطوة على حدة لأنواع مختلفة من التفاعلات مع معلمات حركية خاصة بها، مثل طاقة التنشيط وترتيب التفاعل وعامل ما قبل الأسي. واستنادًا إلى النتائج، يستطيع برنامج Kinetics Neo محاكاة التفاعل (التفاعلات) لبرامج درجات الحرارة التي يحددها المستخدم.
النتائج والمناقشة
قياسات TGA
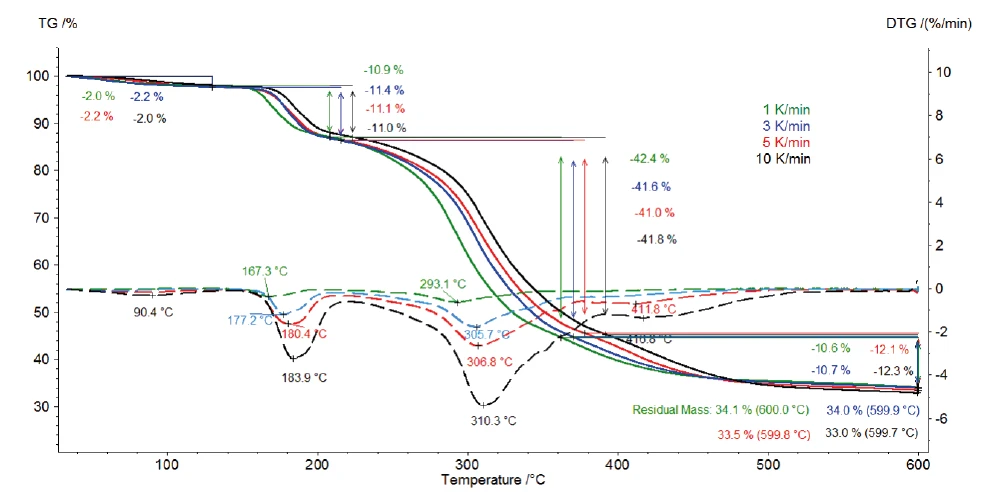
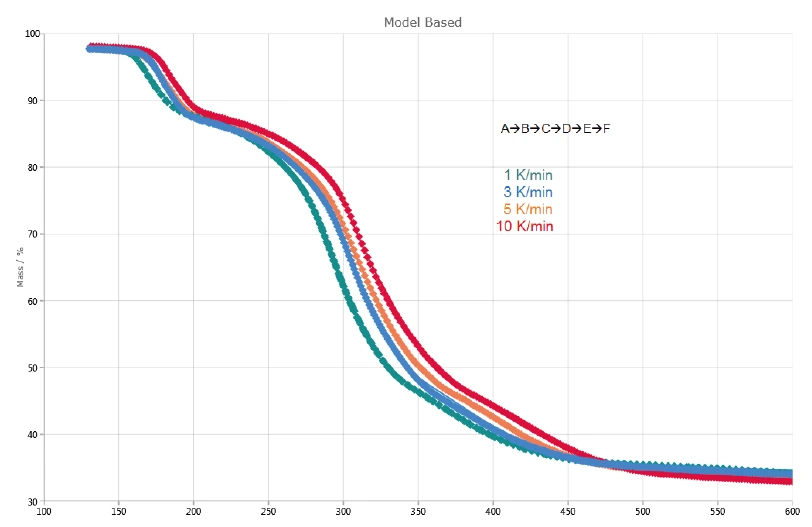
يصور الشكل 2 منحنيات TGA وDTGA (المشتق الأول) للقياسات على كلافولانات البوتاسيوم عند معدلات تسخين 1 و3 و5 و10 كلفن/الدقيقة. تنتج الخطوة الأولى لفقدان الكتلة، التي تم اكتشافها بين درجة حرارة الغرفة و120 درجة مئوية، من تبخر الماء السطحي [13]. علاوة على ذلك، ترجع خطوات فقدان الكتلة الثلاث التي تم تحديدها بين 120 درجة مئوية و600 درجة مئوية إلى تحلل كلافولانات البوتاسيوم. يتم نقلها إلى درجات حرارة أعلى مع زيادة معدلات التسخين (التأثير الحركي). على سبيل المثال، عند معدل تسخين قدره 1 كلفن/دقيقة، تحدث خطوة التحلل الأولى عند 167 درجة مئوية (ذروة التحلل عند درجة حرارة 167 درجة مئوية)، بينما عند معدل تسخين قدره 10 كلفن/دقيقة تحدث عند 184 درجة مئوية (ذروة التحلل عند درجة حرارة 184 درجة مئوية). تصبح خطوة التحلل الأخيرة أكثر وضوحًا مع زيادة معدل التسخين: عند معدل تسخين قدره 5 كلفن/دقيقة، تُلاحظ ذروة التحلل DTG عند 412 درجة مئوية (منحنى متقطع أحمر)، بينما عند 10 كلفن/دقيقة تحدث عند 417 درجة مئوية (منحنى متقطع أسود).
التحليل الحركي للتحلل الحراري
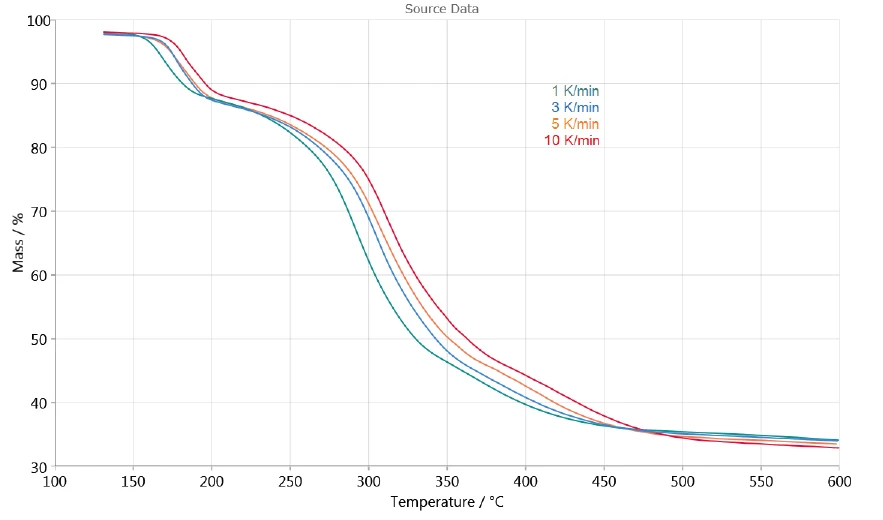
يسمح اعتماد التحلل على معدل التسخين بتقييم العملية بمساعدة برنامج NETZSCH Kinetics Neo. يوضح الشكل 3 منحنيات قياس TGA بين 130 درجة مئوية و600 درجة مئوية المستخدمة للتقييم الحركي. لم يتم أخذ إطلاق الماء السطحي عند درجات حرارة أقل من 130 درجة مئوية في الاعتبار.
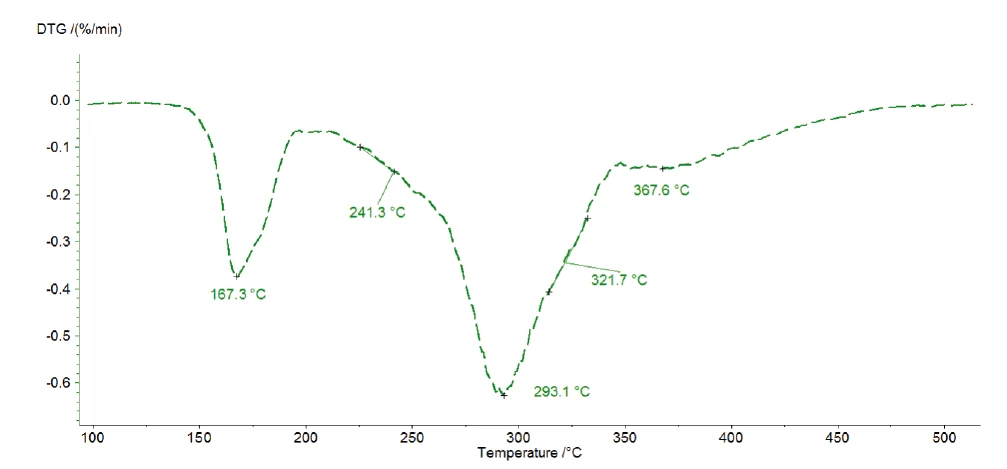
ويشير الفقد الكتلي الثلاث المتتالي المكتشف إلى ثلاث خطوات تحلل على الأقل. يُظهر منحنى DTG للقياس عند 1 كلفن/الدقيقة المعروض في الشكل 4 ثلاث قمم عند 167 درجة مئوية و293 درجة مئوية و368 درجة مئوية، ولكن أيضًا كتفين مع درجات حرارة بداية عند 241 درجة مئوية و322 درجة مئوية. وهذا هو السبب في أن Kinetics Neo تقترح نموذجًا حركيًا بخمس خطوات متتالية من الرتبة ن .
يتم وصف معدل التفاعل لكل خطوة ي بواسطة الدالة: معدل التفاعل j = Aj - f(ej,pj) - exp[-Ej/RT]
Aj: عامل ما قبل الأسي
Ej: طاقة التنشيط [J.mol-1]
T: درجة الحرارة [K]
R: ثابت الغاز (8.314 J.K-1.mol-1)
f(ej,pj): دالة تعتمد على تركيز المتفاعل الأولي
ej وتركيز الناتج pj
يقارن الشكل 5 بين منحنيات TGA المقاسة (الخطوط المنقطة) مع المنحنيات المحسوبة (الخطوط المتصلة) للنموذج المختار المكون من 5 خطوات. تم تحقيق معامل ارتباط عالٍ، >0.999، بين البيانات المقاسة والمحسوبة.
يلخص الجدول 1 نتائج التقييم الحركي لكل خطوة. يتم حساب فقدان الكتلة النظري بضرب مساهمة خطوة التفاعل في التحلل مع إجمالي فقدان الكتلة الذي يحدث أثناء التحلل.
ترتبط خطوة التحلل الأولى، A →B، بفقد كتلة محسوب بنسبة 11.9% ويتوافق مع القيم التجريبية البالغة 11%. ويبلغ الفقد الكتلي للخطوة الأخيرة، E→F، 13.9%. وهذا أعلى قليلًا من القيمة التجريبية البالغة 11-12%. وهذا يعني أن خطوة فقدان الكتلة الأخيرة تبدأ في وقت مبكر (<360 درجة مئوية). يبلغ إجمالي فقدان الكتلة للخطوات B →C وC →D وD →E 36.9% ويقابل عملية التحلل المعقدة حول 300 درجة مئوية (ذروة DTG) في الشكل 2.
جدول 1: البارامترات الحركية للتحلل الحراري لكلافولانات البوتاسيوم
| خطوة التفاعل | أ → ب | ب → ج | ج → د | د → ه | ه → و |
|---|---|---|---|---|---|
| طاقة التنشيط [كيلوجول/مول] | 265.1 | 240.8 | 260.5 | 179.8 | 166.5 |
| العامل الأسي المسبق | 28.6 | 21.6 | 21.7 | 13.3 | 10.5 |
| ترتيب التفاعل | 3.6 | 2.1 | 1.8 | 1.6 | 3.4 |
| المساهمة | 0.190 | 0.099 | 0.244 | 0.246 | 0.222 |
| فقدان الكتلة النظري | 11.9% | 6.2% | 15.3% | 15.4% | 13.9% |
يؤكد الارتباط الجيد للقياسات مع تفاعلات الرتبة التاسعة الاستنتاجات المستخلصة في [8] أنه على عكس سلوك التحلل في المحاليل، فإن تحلل كلافولانات البوتاسيوم في الحالة الصلبة لا يتم تحفيزه ذاتيًا.
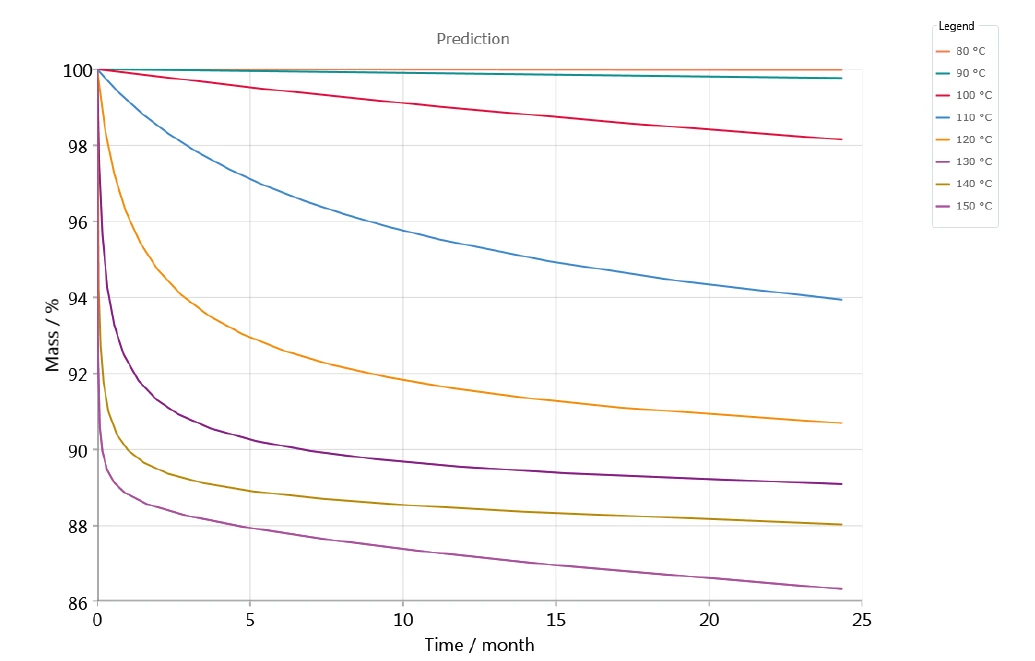
تم إجراء التقييم الحركي بمعامل ارتباط عالٍ وبالتالي مستوى عالٍ من الاتفاق بين منحنيات TGA المقاسة والمحاكاة، بحيث يمكن التنبؤ بالسلوك طويل الأجل في ظل درجات حرارة تخزين مختلفة. وكمثال على ذلك، يوضح الشكل 6 التغير في الكتلة مقابل الزمن استنادًا إلى نموذج من 5 خطوات بخطوات متتالية؛ ويمثل هذا الشكل التنبؤ بتحلل كلافولانات البوتاسيوم لدرجات حرارة مختلفة بين 80 درجة مئوية و150 درجة مئوية في جو نيتروجيني. مع زيادة درجة الحرارة، يزداد التحلل. يمكن ملاحظة هذا التأثير بالفعل عند درجة حرارة تخزين تبلغ 90 درجة مئوية (المنحنى الأخضر في الطرف العلوي من الرسم البياني - الشكل 6).
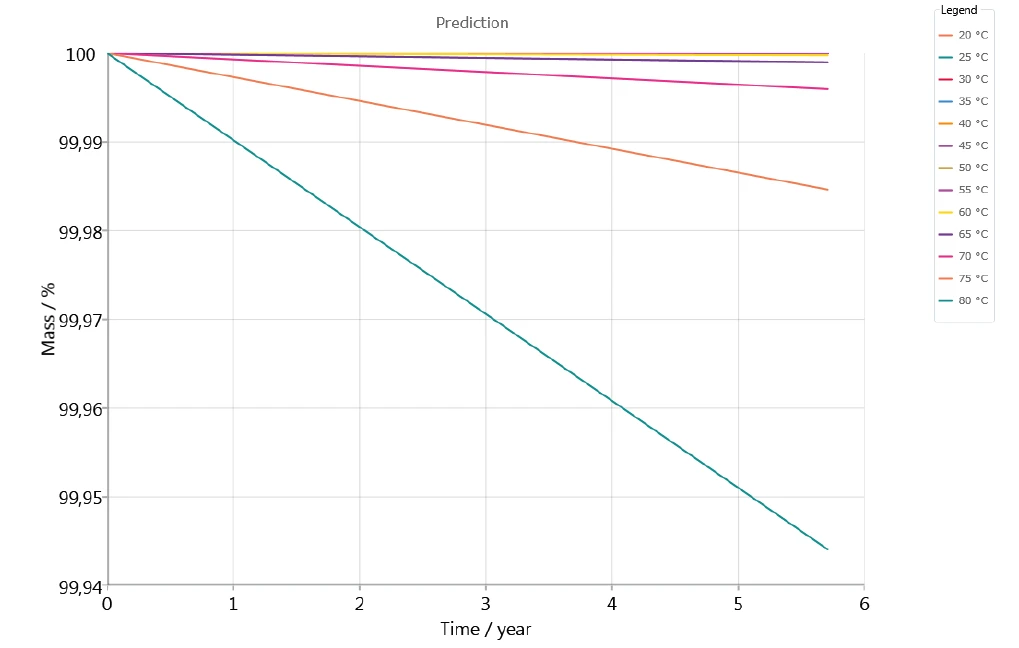
يوضح الشكل 7 ثبات الدواء في جو خامل على مدار 5 سنوات، لدرجات حرارة تتراوح بين 20 درجة مئوية و80 درجة مئوية. يبدو أنه لا يحدث فقدان كبير في الكتلة في التنبؤ لدرجات الحرارة حتى 60 درجة مئوية.
يجب التذكير هنا بأن حركية التحلل أجريت على عينة جافة. ومع ذلك، فإن الماء له تأثير كبير على تحلل كلافولانات البوتاسيوم: فالتخزين في جو رطب ينقل تحللها إلى درجات حرارة منخفضة [10]. يوضح J. Cieleka-Piontek أن عينات كلافولانات البوتاسيوم تتحلل بشكل أسرع إذا ما تعرضت لزيادة رطوبة الهواء مقارنةً بتعرضها للهواء الجاف، ويشير إلى أن هجوم جزيء الماء على مجموعة الكربونيل لحلقة ß-lactam يحفز التحلل الحراري [8].
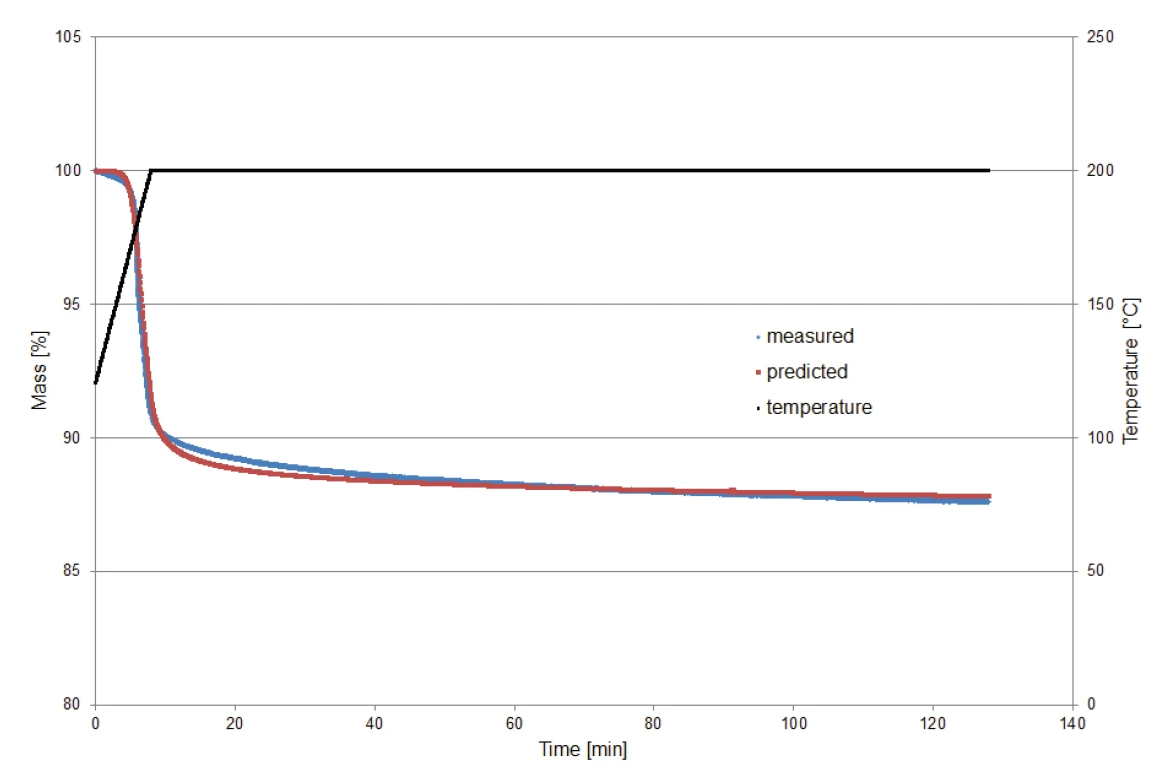
وللتحقق من صحة النموذج الحركي المحسوب بواسطة Kinetics Neo للتنبؤ بسلوك التحلل في ظل ظروف متساوية الحرارة، تم تسخين عينة من كلافولانات البوتاسيوم تبلغ 9.23 ملجم إلى 200 درجة مئوية ثم تُركت متساوية الحرارة لمدة ساعتين. بدأت مراقبة القياس عند درجة حرارة 120 درجة مئوية من أجل استبعاد تأثير الفقد الكتلي لإطلاق الماء السطحي.
يقارن الشكل 8 بين خسائر الكتلة المحددة عن طريق القياس وتلك المحددة عن طريق التنبؤ (حركية نيو). تُظهر المقارنة الاتفاق الجيد بين المنحنيين وبالتالي موثوقية الحساب.
الخاتمة
تم بحث حركية التحلل الحراري لكلافولانات البوتاسيوم في الحالة الصلبة تحت النيتروجين عن طريق قياس الثقل الحراري وحركية نيو. يمكن الحصول على مستوى عالٍ من الارتباط بين البيانات المقاسة والمحاكاة باستخدام نموذج حركي من خمس خطوات متتالية حيث تكون كل خطوة من الرتبة ن. وهذا يسمح بالتنبؤ بسلوك التخزين في ظل درجات حرارة مختلفة ودرجات حرارة وفترات مختلفة.
يتم التحقق من صحة النتائج من خلال مقارنة قياس TGA في ظل ملف تعريف درجة حرارة محدد بما في ذلك الجزء المتساوي الحرارة بالتنبؤات المحسوبة بواسطة Kinetics Neo.