Einleitung
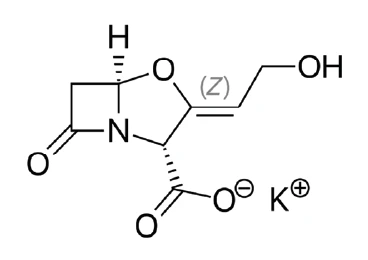
Kaliumclavulanat (Abbildung 1) ist ein Salz der Clavulansäure, ein von Streptomyces clavuligerus [1] produzierter Wirkstoff, der einige von Bakterien gebildete ß-Lactamasen hemmt. Verabreicht als Monosubstanz hat es nur eine schwache antibakterielle Wirkung gegen die meisten Organismen – in Kombination mit dem Antibiotikum Amoxicillin ist es jedoch wirksam gegen ß-Lactamase-produzierende Staphylococcusbakterien, die gegen Amoxicillin alleine resistent sind [2, 3]. Deshalb ist Kaliumclavulanat eine etablierte Substanz in der Pharmaindustrie.
Amoxicillin und Kaliumclavulanat weisen ähnliche Zersetzungswege auf. Die Stabilität der Amoxicillin-Clavulanat- Kombination hängt jedoch hauptsächlich vom Clavulanat ab, da es sich leichter abbaut [4, 5].
Zahlreiche Forschungsarbeiten berichten bereits über das Zersetzungsverhalten von Kaliumclavulanat [3, 4, 7, 12]. Darin wurde die Substanz generell in Lösungen mit unterschiedlichen pH-Werten und in Kombination mit Amoxicillin untersucht. Einerseits wird die Stabilität der Amoxicillin/Clavulansäure-Mischung durch einen Temperaturanstieg von 25°C auf 40 °C [3] beeinflusst und andererseits erhöht sich die Haltbarkeit der Mischung erheblich, wenn die Lösung auf einen niedrigeren pHWert eingestellt wird [4]. Desweiteren ist zu beobachten, dass in Lösungen der Abbau von Clavulansäure durch Hydrolyseprodukte katalysiert wird [12]. Wie die Anwendung der HPLC-Methode an bei unterschiedlichen Temperaturen und atmosphärischen Bedingungen gelagerten Proben zeigt, folgt die Zersetzung von Kaliumclavulanat im festen Zustand einem anderen Mechanismus: Die in der Festphase gebildeten Zersetzungsprodukte haben keine katalytische Wirkung [8].
Die Thermische StabilitätEin Material ist thermisch stabil, wenn es sich unter Temperatureinfluss nicht zersetzt. Eine Möglichkeit, die thermische Stabilität einer Substanz zu bestimmen ist die Verwendung eines TGA (thermogravimetrischer Analysator).thermische Stabilität kann mittels Thermogravimetrie untersucht werden. Unter anderem kann damit die Zersetzungs- oder eine Reaktionstemperatur und ReaktionsenthalpieReaktionstemperatur und Reaktionsenthalpie können mit z.B. mit Hilfe der dynamischen Differenz Thermoanalyse (DSC) bestimmt werden. Das Verfahren dazu ist z.B. in der DIN EN ISO 11357-5 beschrieben.Reaktionstemperatur bestimmt werden [9]. Die thermische Zersetzung von festem Kaliumclavulanat wurde mit einer Thermowaage, gekoppelt an ein FT-IR-Spektrometer, charakterisiert [13]. Im Folgenden wurden die thermogravimetrische Messungen für kinetische Studien der ZersetzungsreaktionEine Zersetzungsreaktion ist eine thermisch induzierte Reaktion einer chemischen Substanz, die fest und/oder gasförmige Zersetzungsprodukte bildet.Zersetzungsreaktion herangezogen.
Dies erlaubt für Kaliumclavunat eine Vorhersage zum Zersetzungsverhalten unter spezifischen Temperaturund Zeitbedingungen zu treffen.
Liegen Kenntnisse zur thermischen Stabilität und ist der Zersetzungsprozess von Kaliumclavulanat im festen Zustand verstanden, dann ist die Optimierung der Lagerbedingungen möglich.
Versuchsbedingungen
Die TG-Messungen wurden mit der NETZSCH-Thermowaage TG 209 F1 Libra® mit automatischem Probenwechsler (ASC) durchgeführt. Aus der in [13] beschriebenen TG-FT-IR-Messung wissen wir, dass die Probe gleich zu Messbeginn Oberflächenwasser freisetzt. Deshalb wurden die nächsten Messungen mit geschlossenen Aluminiumtiegeln durchgeführt. Unmittelbar vor Messbeginn wurde der Tiegeldeckel mit der automatischen Anstechvorrichtung des ASC gelocht. Dies verhindert, dass die Probe bereits vor Beginn der eigentlichen Messung Oberflächenwasser freisetzt, was zur Verfälschung der Ausgangsmasse führt und damit zur Verfälschung der weiteren Bestimmung von Massenverlusten.
Die Proben mit Einwaagen zwischen 4,33 und 5,04 mg wurden zwischen Raumtemperatur und 600 °C mit Heizraten von 1 K/min bis 10 K/min in dynamischer Stickstoffatmosphäre (40 ml/min) aufgeheizt.
Die erhaltenen TG-Kurven dienten als Basis für die anschließende kinetische Auswertung der Zersetzungsreaktion.
Dafür wurde die Software Kinetics Neo (der NETZSCHGerätebau GmbH) verwendet. Sie erlaubt die kinetische Modellierung von ein- bis mehrstufigen Reaktionen.
Diese Software kann jede Stufe unterschiedlichen Reaktionstypen mit eigenen kinetischen Parametern wie Aktivierungsenergie, Reaktionsordnung und Präexponentialfaktor zuordnen. Auf Basis dieser Ergebnisse kann man mittels Kinetics Neo die Reaktion(en) für anwenderspezifische Temperaturprogramme simulieren.
Ergebnisse und Diskussion
TG-Messungen
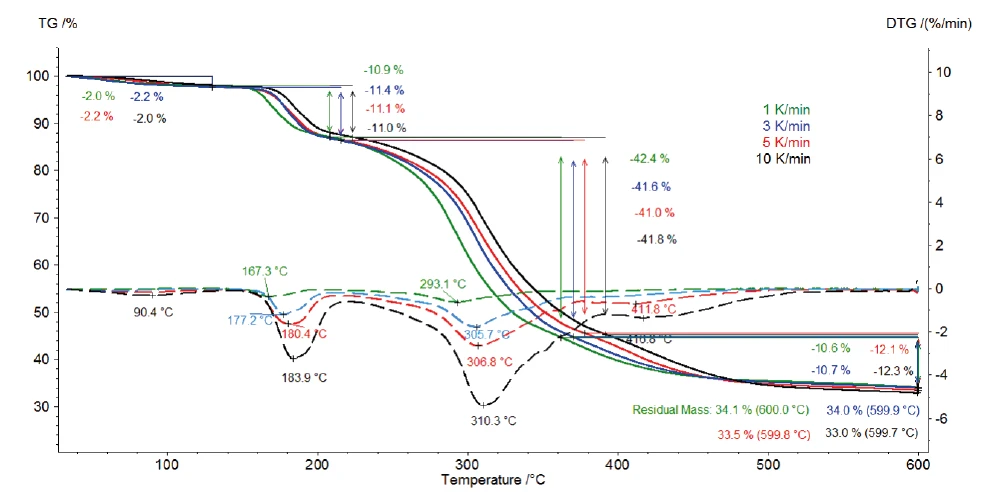
Abbildung 2 zeigt die TG- und DTG (erste Ableitung)- Kurven der Messung an Kaliumclavulanat mit Heizraten von 1, 3, 5 und 10 K/min. Die erste zwischen Raumtemperatur und 120 °C detektierte Massenverluststufe ist wie bereits oben beschrieben auf die Freisetzung von Oberflächenwasser zurückzuführen [13]. Desweiteren sind die drei zwischen 120 °C und 600 °C identifizierten Massenverluststufen der Zersetzung von Kaliumclavulanat zuzuschreiben. Diese sind mit ansteigenden Heizraten zu höheren Temperaturen verschoben (kinetischer Einfluss). So tritt zum Beispiel mit einer Heizrate von 1 K/min die erste Zersetzungsstufe bei 167 °C (DTG-Peak) auf, während sie mit einer Heizrate von 10 K/min bei 184 °C (DTG-Peak) auftritt. Eine Zunahme der Heizrate prägt die Zersetzungsstufe weiter aus: Mit einer Heizrate von 5 K/min wird der DTG-Peak bei 412 °C (rot gestrichtelte Kurve) und mit 10 K/min bei 417 °C (schwarz gestrichelte Kurve) beobachtet.
Kinetische Analyse der thermischen Zersetzung
Die Heizratenabhängigkeit der Zersetzung erlaubt die Auswertung des Prozesses mit Hilfe der NETZSCH Kinetics Neo-Software. Abbildung 3 zeigt die für die kinetische Auswertung herangezogenen TG-Messkurven zwischen 130 °C und 600 °C. Die Freisetzung von Oberflächenwasser bei Temperaturen unterhalb 130 °C wird für diese Auswertung nicht berücksichtigt.
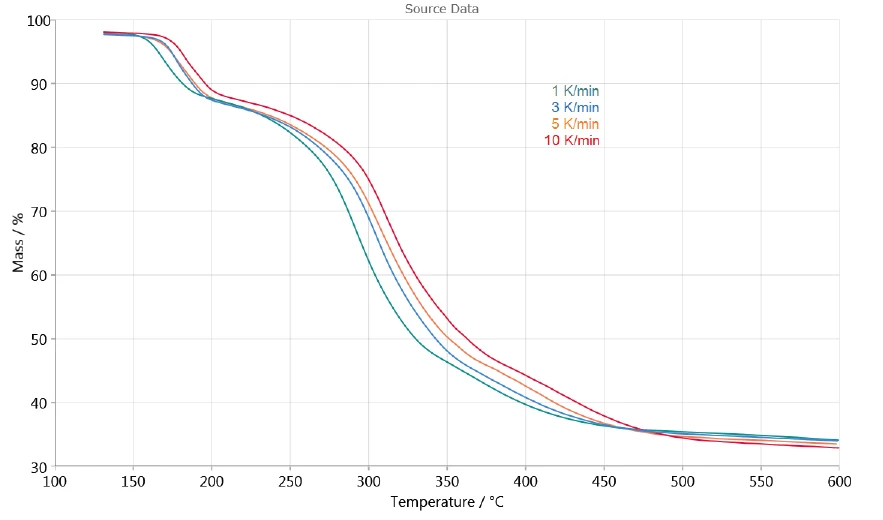
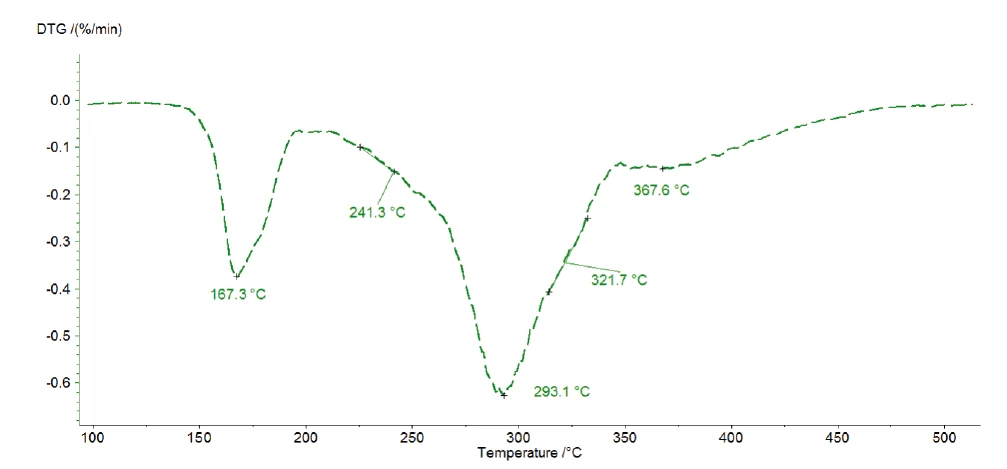
Die drei aufeinanderfolgtenden detektierten Massenverluste lassen drei Zersetzungsstufen vermuten. Die in Abbildung 4 dargestellte DTG-Kurve der Messung mit 1 K/min weist drei Peaks bei 167 °C, 293 °C und 368 °C, aber auch Schultern mit Onsettemperaturen bei 241 °C und 322 °C auf. Kinetics Neo kennt diese Bereiche und schlägt daher ein Kinetikmodell mit fünf aufeinanderfolgenden Stufen n-ter Ordnung vor.
Die Reaktionsgeschwindigkeit jeder Stufe j wird durch folgende Funktion beschrieben: Reaktionsratej = Aj · f(ej,pj) · exp[-Ej/RT]
Aj: Präexponentialfaktor
Ej: Aktivierungsenergie [J.mol-1]
T: Temperatur [K]
R: Gaskonstante (8.314 J.K-1.mol-1)
f(ej,pj): Funktion, abhängig von der Konzentration des ursprünglichen Reaktanten ej und der Konzentration des Produkts pj
In Abbildung 5 ist ein Vergleich der gemessenen TG-Kurven (gestrichelte Linien) und der berechneten Kurven (durchgezogene Linien) aus Basis des gewählten 5-stufigen Modells dargestellt. Zwischen den gemessenen und berechneten Daten wird ein hoher Korrelationskoeffizient von >0,999 erzielt.
Tabelle 1 fasst die Ergebnisse der kinetischen Auswertung für jede Stufe zusammen. Der theoretische Massenverlust errechnet sich aus der Multiplikation des Beitrags der Zersetzungsstufe mit dem gesamten während der Zersetzung auftretenden Massenverlust.
Die erste Zersetzungsstufe A→B ist mit einem berechneten Massenverlust von 11,9 % verbunden und entspricht den experimentellen Werten von 11 %. Der Massenverlust für die letzte Stufe E→F beträgt 13,9 %. Dies ist geringfügig höher als der experimentelle Wert von 11 - 12 % und bedeutet, dass die letzte Massenverluststufe früher einsetzt (< 360°C). Der gesamte Massenverlust der Stufen B→C, C→D und D→E beläuft sich auf 36,9 % und entspricht dem komplexen Zersetzungsprozess bei ca. 300 °C (DTGPeak) in Abbildung 2.
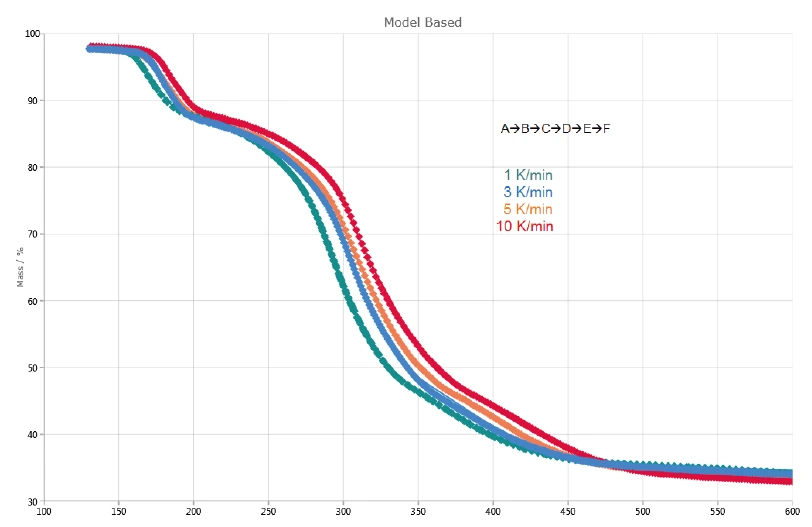
Tabelle 1: Kinetische Parameter des thermischen Abbaus von Kaliumclavulanat
| Reaktionsstufe | A → B | B → C | C → D | D → E | E → F |
|---|---|---|---|---|---|
| Aktivierungsenergie [kJ/mol] | 265,1 | 240,8 | 260,5 | 179,8 | 166,5 |
| Präexponentialfaktor | 28,6 | 21,6 | 21,7 | 13,3 | 10,5 |
| Reaktionsordnung | 3,6 | 2,1 | 1,8 | 1,6 | 3,4 |
| Beitrag | 0,190 | 0,099 | 0,244 | 0,246 | 0,222 |
| Theoretischer Massenverlust | 11,9 % | 6,2 % | 15,3 % | 15,4 % | 13,9 % |
Die gute Übereinstimmung der Messungen mit Reaktionen n-ter Ordnung bestätigt die aus [8] abgeleiteten Schlussfolgerungen, dass die Zersetzung von Kaliumclavulanat im festen Zustand im Gegensatz zu seinem Zersetzungsverhalten in Lösungen nicht autokatalysiert ist.
Die kinetische Auswertung wurde mit einem hohen Korrelationskoeffizienten durchgeführt und somit einer hohen Übereinstimmung zwischen den gemessenen und simultierten TG-Kurven, sodass Vorhersagen über das Langzeitverhalten bei unterschiedlichen Lagertemperaturen möglich sind.
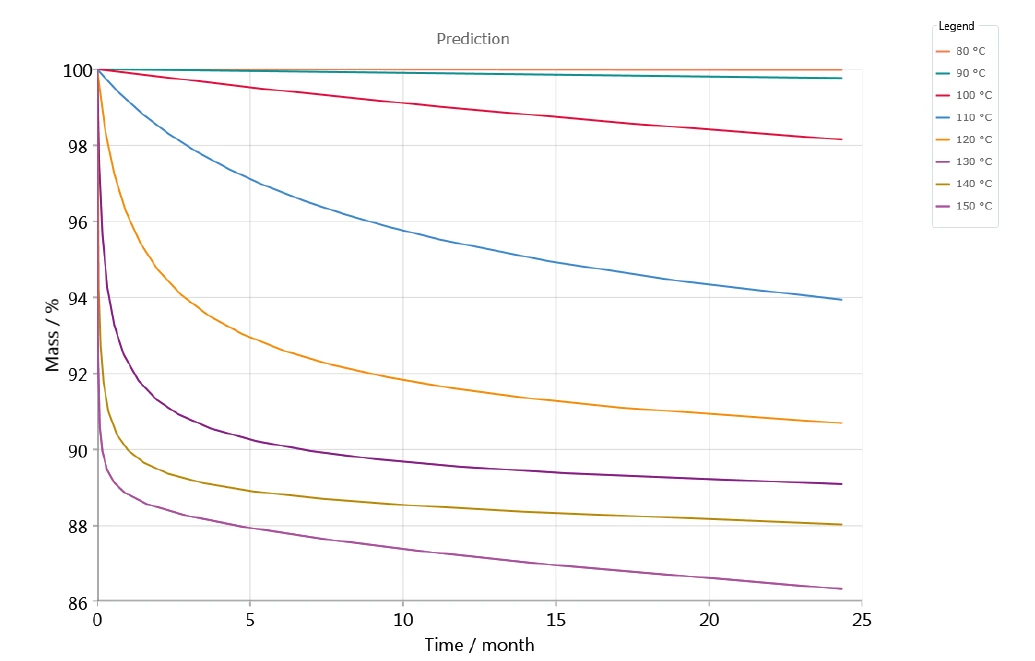
Abbildung 6 zeigt beispielhaft die Massenänderungen gegen die Zeit auf Basis eines 5-stufigen Modells mit aufeinanderfolgenden Stufen; dies stellt die Vorhersage der Zersetzung von Kaliumclavulanat für verschiedene- Temperaturen zwischen 80 °C und 150 °C in Stickstoffatmosphäre dar. Die Zersetzung nimmt mit steigender Temperatur zu. Dieser Effekt kann bereits bei einer Lagertemperatur von 90 °C (grüne Kurve am oberen Ende der Grafik – Abbildung 5) beobachtet werden.
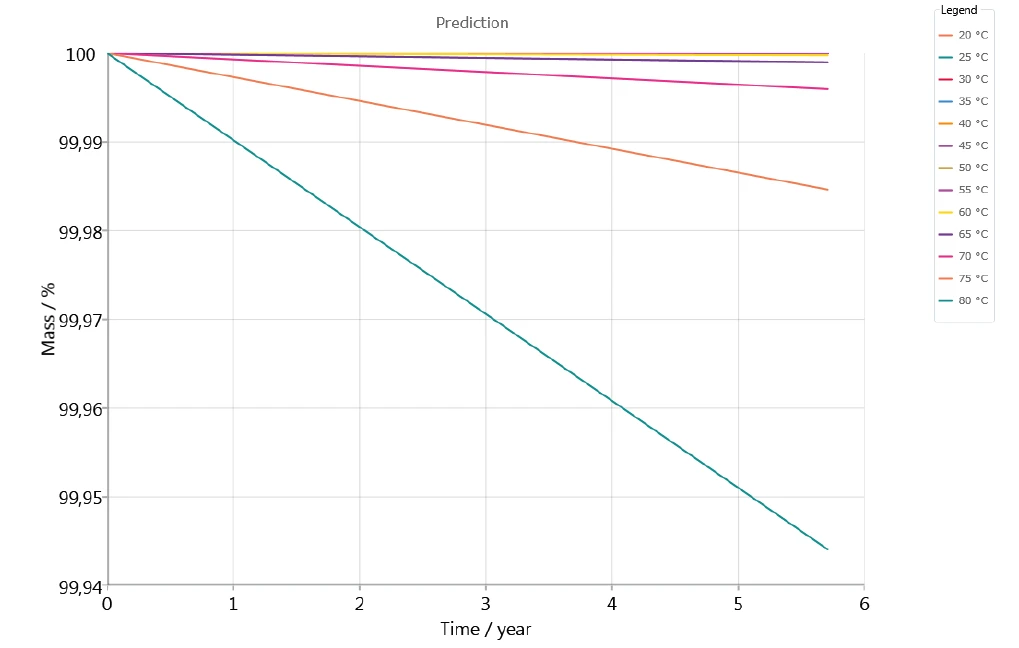
Abbildung 7 zeigt die Stabilität des Arzneimittels in inerter Atmosphäre über einen Zeitraum von 5 Jahren für Temperaturen zwischen 20 °C und 80 °C. Es scheint, dass in der Vorhersage kein signifikanter Massenverlust für Temperaturen bis 60 °C auftritt.
Erinnern wir uns an dieser Stelle, dass die Zersetzungskinetik an einer trockenen Probe durchgeführt wurde. Wasser hat jedoch großen Einfluss auf die Zersetzung von Kaliumclavulanat: Die Lagerung in trockener Atmosphäre verschiebt die Zersetzung zu niedrigeren Temperaturen [10]. J. Cieleka-Piontek zeigt, dass sich Kaliumclavulanat-Proben unter Einwirkung von erhöhter Luftfeuchtigkeit schneller zersetzen und schlägt vor, dass der Angriff eines Wassermoleküls auf die Carbonylgruppe des ß-Lactamrings eine Thermolyse induziert [8].
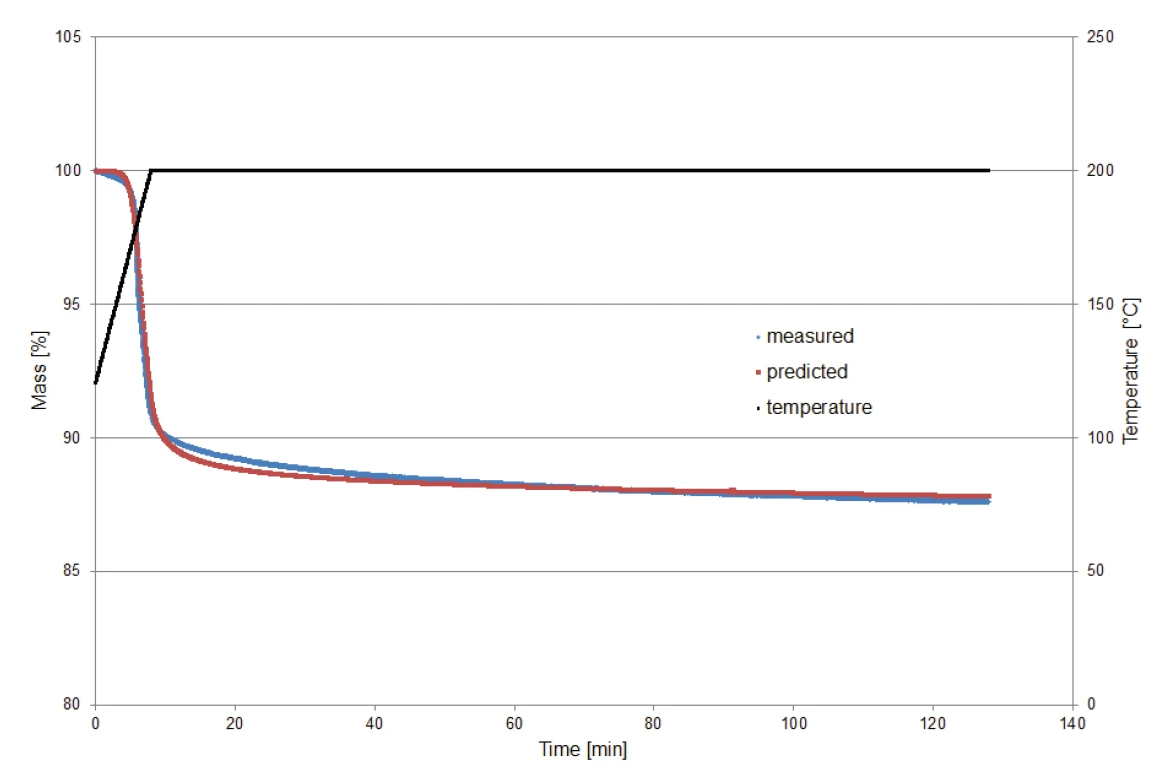
Um das von Kinetics Neo vorgeschlagene kinetische Modell, berechnet unter isothermen Bedingungen, zu validieren, wurde eine Kaliumclavulanat-Probe von 9,23 mg auf 200 °C aufgeheizt und dann für zwei Stunden IsothermUntersuchungen bei geregelter und konstanter Temperatur werden als isotherm bezeichnet.isotherm gehalten. Die Aufzeichnung der Messung begann bei 120 °C, um den Massenverlusteffekt der Freisetzung von Oberflächenwasser auszuschließen.
Abbidung 8 zeigt einen Vergleich der mittels Messungen bestimmten Massenverluste mit denen, die durch die Vorhersage (Kinetics Neo) bestimmt wurden. Der Vergleich zeigt die gute Übereinstimmung zwischen den beiden Kurven und somit die Zuverlässigkeit der Berechnung.
Zusammenfassung
Die Kinetik der thermischen Zersetzung von Kaliumclavulanat im festen Zustand unter Stickstoff wurden mittels Thermogravimetrie und Kinetics Neo untersucht. Eine hohe Korrelation zwischen den gemessenen und simulierten Daten kann durch Anwendung eines aufeinanderfolgenden 5-stufigen kinetischen Modells erreicht werden, bei dem jede Stufe n-ter Ordnung ist. Damit lassen sich Vorhersagen des Lagerverhaltens unter unterschiedlichen Temperaturen, Temperaturprofilen und -perioden treffen.
Die Ergebnisse wurden durch den Vergleich der TG-Messungen unter einem bestimmen Temperaturprofil mit isothermen Segment mit den von Kinetics Neo berechneten Vorhersagen bestätigt.