Εισαγωγή
Στη φαρμακευτική, δεν υπάρχει σχεδόν κανένα δραστικό συστατικό για το οποίο να έχουν γραφτεί περισσότερα από το ακετυλοσαλικυλικό οξύ (ή ASA για συντομία- στις αγγλόφωνες χώρες χρησιμοποιείται συχνά ως συνώνυμο ακόμη και η εμπορική ονομασία Aspirin™). Η ιστορία της επιτυχίας του ξεκίνησε στα τέλη του 19ου αιώνα, όταν ο Dr. Felix Hoffmann συνέθεσε την ουσία στα εργαστήρια της BAYER για πρώτη φορά χωρίς προσμίξεις. Σήμερα, εξακολουθεί να είναι ένα από τα πιο δημοφιλή φαρμακευτικά προϊόντα που χρησιμοποιούνται σε ένα ευρύ θεραπευτικό φάσμα. Ανήκει στην ομάδα των μη στεροειδών αντιφλεγμονωδών φαρμάκων (ΜΣΑΦ) και ενδείκνυται για τη θεραπεία του πόνου, του πυρετού και της φλεγμονής. Επιπλέον, χρησιμοποιείται για την πρόληψη της επανεμφάνισης καρδιακής προσβολής ή εγκεφαλικού επεισοδίου σε ασθενείς υψηλού κινδύνου. Το 1977, το ASA προστέθηκε ως αναλγητικό στον "κατάλογο βασικών φαρμάκων" του ΠΟΥ (Παγκόσμιος Οργανισμός Υγείας) [1].
Αυτό είναι το δεύτερο από τα τέσσερα σημειώματα εφαρμογής που εξετάζουν λεπτομερέστερα τη θερμική συμπεριφορά του ακετυλοσαλικυλικού οξέος: [2] [3] [4].
Κινητική ανάλυση θερμοαναλυτικών δεδομένων
Με τα δεδομένα μέτρησης των θερμοαναλυτικών μεθόδων μπορούν να ληφθούν πληροφορίες σχετικά με την απώλεια μάζας λόγω αποσύνθεσης, πυρόλυσης ή καύσης, σχετικά με ενεργειακές μεταβολές όπως τήξη ή κρυστάλλωση ή επίσης σχετικά με μεταβολές στη διάσταση του δείγματος λόγω θερμικής διαστολής ή πυροσυσσωμάτωσης, για παράδειγμα, σε κεραμικά υλικά. Με αυτές τις δηλώσεις, ωστόσο, το περιεχόμενο των πληροφοριών δεν χρησιμοποιείται εξαντλητικά. Με τη βοήθεια μιας πιο ολοκληρωμένης κινητικής ανάλυσης, είναι επίσης δυνατόν να ληφθούν πληροφορίες σχετικά με την έγκαιρη πορεία μιας αντίδρασης σε διαφορετικές θερμοκρασίες, δηλαδή τον ρυθμό αντίδρασης. Εάν η πορεία μιας αντίδρασης μπορεί να περιγραφεί αρκετά καλά με τη βοήθεια ενός συστήματος μαθηματικών εξισώσεων, είναι επίσης δυνατό να γίνουν προβλέψεις για την πορεία της αντίδρασης που πειραματικά δεν είναι προσβάσιμες ή μόνο με δυσκολία. Αυτό, με τη σειρά του, μπορεί να χρησιμοποιηθεί για τη βελτιστοποίηση διεργασιών ή για την πρόβλεψη της διάρκειας ζωής, της οξειδωτικής σταθερότητας ή της συμπεριφοράς γήρανσης υλικών και προϊόντων.
Αποτελέσματα και συζήτηση
Για την καλύτερη κατανόηση της θερμικής συμπεριφοράς του ακετυλοσαλικυλικού οξέος, πραγματοποιήθηκε μια κινητική προσέγγιση σε μια προσπάθεια να βρεθεί ένα σύστημα μαθηματικών εξισώσεων για την περιγραφή των πειραματικών δεδομένων. Η θερμική συμπεριφορά μελετήθηκε με τη χρήση ενός NETZSCH TG 209 F1 Libra® και εφαρμόζοντας τις συνθήκες μέτρησης που συνοψίζονται στον πίνακα 1. Μια κινητική προσέγγιση απαιτεί μια σειρά τουλάχιστον τριών διαφορετικών ρυθμών θέρμανσης προκειμένου να περιγραφεί η συσχέτιση χρόνου-θερμοκρασίας, η οποία αποτελεί τον κύριο στόχο των κινητικών αξιολογήσεων γενικά.
Πίνακας 1: Παράμετροι μέτρησης TGA
| Παράμετροι | Ακετυλοσαλικυλικό οξύ |
|---|---|
| Μάζα δείγματος [mg] | 4.982 │ 5.014 │ 5.053 |
| Ατµόσφαιρα | Αργό |
| Χωνευτήρι | Al2O3, 85 μl, ανοικτό |
| Πρόγραμμα θερμοκρασίας | RT - 450°C |
| Ρυθμοί θέρμανσης [K/min] | 3 │ 10 │ 30 |
| Ρυθμός ροής αερίου [ml/min] | 40 |
| Υποδοχή δείγματος | TGA |
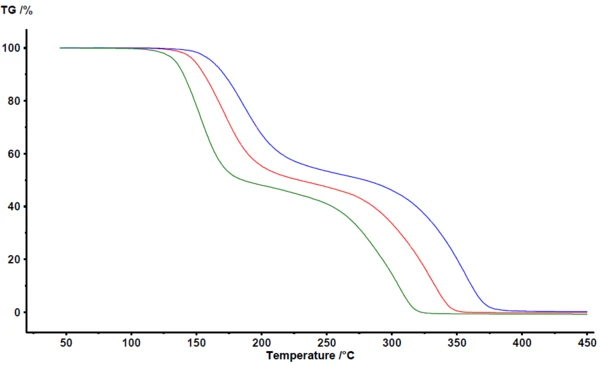
Στο σχήμα 1 απεικονίζονται τα αποτελέσματα όπως προκύπτουν από το λογισμικό ανάλυσης NETZSCH Proteus® . Μεταξύ 100°C και 400°C, η θερμοβαρυμετρία ανιχνεύει δύο σημαντικά στάδια απώλειας μάζας για την πυρόλυση του ακετυλοσαλικυλικού οξέος. Οι καμπύλες TGA μετατοπίζονται σε υψηλότερες θερμοκρασίες με την αύξηση του ρυθμού θέρμανσης. Η παράλληλη μετατόπιση largely, καθώς και η σχεδόν ταυτόσημη τελική μάζα, υποδεικνύουν ότι ο ίδιος ο ρυθμός θέρμανσης δεν μεταβάλλει σημαντικά τον μηχανισμό της αντίδρασης. Αυτό αποτελεί επίσης σαφή ένδειξη ότι ο μηχανισμός της αντίδρασης δεν είναι πολύ περίπλοκος σε αυτή την περίπτωση. Από την άλλη πλευρά, φαίνεται σαφώς ότι τα στάδια απώλειας μάζας δεν διαχωρίζονται απόλυτα. Δεν είναι ορατό κανένα οροπέδιο που να ορίζει σαφώς το τέλος του πρώτου βήματος απώλειας μάζας ή την αρχή του δεύτερου βήματος απώλειας μάζας. Όπως επιβεβαιώνεται με τεχνικές σύζευξης όπως TGA-FT-IR, TGA-MS ή TGA-GC-MS, τόσο η πυρόλυση όσο και η εξάτμιση λαμβάνουν χώρα ταυτόχρονα [2][4][5].
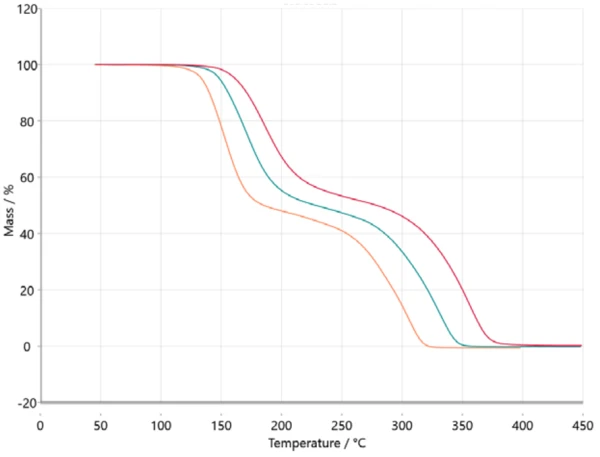
Για την κινητική ανάλυση, τα δεδομένα μέτρησης μεταφέρονται στο λογισμικό NETZSCH Kinetics Neo μέσω ASCII. Τα εισαγόμενα δεδομένα απεικονίζονται στο σχήμα 2.
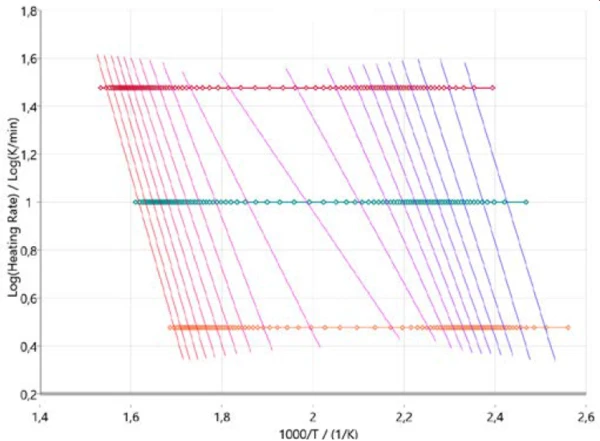
Προκειμένου να αποκτήσουμε μια πρώτη ιδέα για τον μηχανισμό της αντίδρασης, είναι χρήσιμο να ξεκινήσουμε την κινητική ανάλυση με τις λεγόμενες προσεγγίσεις χωρίς μοντέλα. Στο Σχήμα 3 παρουσιάζονται τα αποτελέσματα σύμφωνα με την Ozawa-Flynn-Wall, όπου ο λογάριθμος του ρυθμού θέρμανσης απεικονίζεται συναρτήσει της αντίστροφης θερμοκρασίας. Αυτή η προσέγγιση όχι μόνο λαμβάνει υπόψη όλα τα σημεία μέτρησης, αλλά παρέχει επίσης πληροφορίες σχετικά με τη μεταβολή της ενέργειας ενεργοποίησης καθώς και τον προεκθετικό παράγοντα καθ' όλη τη διάρκεια της αντίδρασης (βαθμός μετατροπής). Αυτό είναι ιδιαίτερα χρήσιμο για αντιδράσεις πολλαπλών βημάτων. Το διάγραμμα περιγράφει την εξέλιξη της αντίδρασης (από τα δεξιά προς τα αριστερά) και για τους τρεις ρυθμούς θέρμανσης (οριζόντια σύμβολα). Οι σχεδόν κατακόρυφες γραμμές συνδέουν τον ίδιο βαθμό μετατροπής για κάθε ρυθμό θέρμανσης και γι' αυτό ονομάζονται γραμμές ισομετατροπής.
Αυτές οι ισο-μετατρεπτικές γραμμές είναι λίγο πολύ παράλληλες στις περιοχές για τα δύο κύρια στάδια πυρόλυσης στην αρχή και στο τέλος της όλης διεργασίας. Στο 50% περίπου της μετατροπής, οι ισο-μετατρεπτικές γραμμές παρουσιάζουν διαφορετική κλίση που υποδηλώνει αλλαγή του μηχανισμού της αντίδρασης. Σε αυτό το στάδιο της αντίδρασης, η πυρόλυση και η εξάτμιση λαμβάνουν χώρα ταυτόχρονα, όπως αναφέρθηκε προηγουμένως [2][4][5].
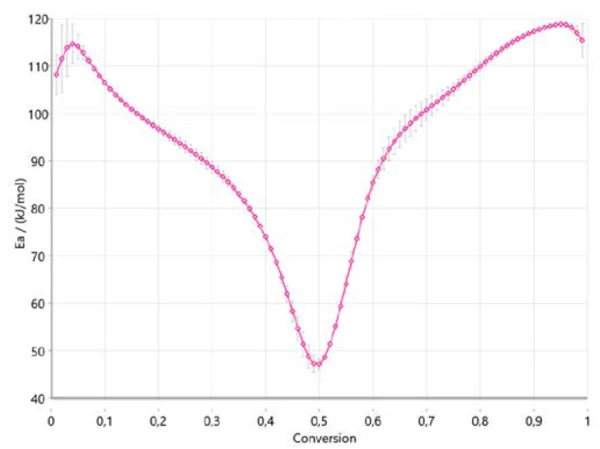
Το Σχήμα 4 δείχνει πώς μεταβάλλεται η ενέργεια ενεργοποίησης με την πρόοδο της αντίδρασης σύμφωνα με τους Ozawa-Flynn-Wall. Πρόκειται για πολύ σημαντική πληροφορία, δεδομένου ότι υποδεικνύει ήδη τρία εύρη για ολόκληρη τη διαδικασία, με ενέργεια ενεργοποίησης περίπου 110 kJ/mol στην αρχή, περίπου 40 kJ/mol μεταξύ 40% και 50% μετατροπής και περίπου 120 kJ/mol στο τέλος της αντίδρασης. Η μεταβολή της ενέργειας ενεργοποίησης με το βαθμό μετατροπής επιβεβαιώνει έναν μηχανισμό αντίδρασης πολλαπλών σταδίων. Οι τιμές που λαμβάνονται βρίσκονται σε καλή συσχέτιση με τα αποτελέσματα που δημοσιεύονται στη βιβλιογραφία [6].
Η μεταφορά αυτών των πληροφοριών σε μια ανάλυση με βάση το μοντέλο οδηγεί σε ένα διαδοχικό μοντέλο τριών σταδίων (t:FnFnFnFn), όπου το Α αντιπροσωπεύει το αρχικό υλικό (ακετυλοσαλικυλικό οξύ), τα Β και Γ είναι ενδιάμεσα προϊόντα γνωστά από τη βιβλιογραφία [6, 7] και το Δ είναι το τελικό προϊόν. Στην περίπτωση αυτή, το τελικό προϊόν δεν είναι, φυσικά, στην πραγματικότητα μια ουσία, αλλά περιγράφει το τέλος της αντίδρασης ή την 100% μετατροπή, δεδομένου ότι η υπολειμματική μάζα και για τις τρεις θερμοβαρυτομετρικές καμπύλες είναι μηδέν. Όλα τα προϊόντα που σχηματίζονται είναι αέρια και επομένως εξατμίζονται από το χωνευτήρι κατά τη θέρμανση στην τελική θερμοκρασία. Το σχήμα 5 απεικονίζει το αποτέλεσμα αυτής της προσέγγισης που βασίζεται σε μοντέλο. Τα μετρούμενα δεδομένα παρουσιάζονται ως σύμβολα και τα αποτελέσματα για το υπολογισμένο μοντέλο τριών διαδοχικών βημάτων παρουσιάζονται ως συνεχείς γραμμές με τα χρώματα που σχετίζονται με τους διαφορετικούς ρυθμούς θέρμανσης. Το υπολογισμένο μοντέλο ταιριάζει σχεδόν απόλυτα με τα πειραματικά δεδομένα, γεγονός που επιβεβαιώνεται τελικά από τον συντελεστή συσχέτισης 0,99986.
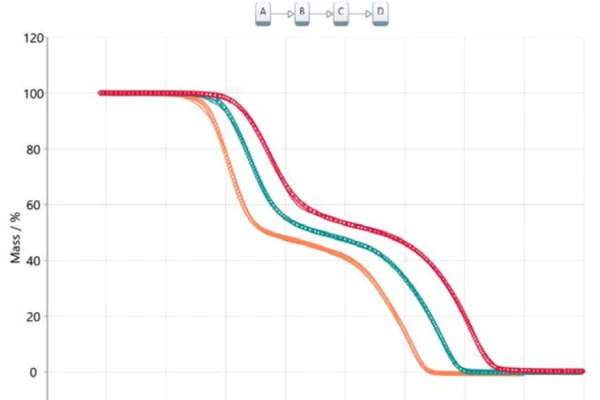
Οι υπολογιζόμενες παράμετροι προεκθετικός παράγοντας, ενέργεια ενεργοποίησης και σειρά αντίδρασης συνοψίζονται στον πίνακα 2 για κάθε επιμέρους βήμα αντίδρασης. Όλες οι τιμές για την ενέργεια ενεργοποίησης βρίσκονται σε καλή συμφωνία με τις τιμές που προτείνονται από την προσέγγιση Ozawa-Flynn-Wall καθώς και με τις τιμές που αναφέρονται στη βιβλιογραφία [6]. Η συνεισφορά καθενός από τα τρία στάδια της αντίδρασης είναι 40,3%, 13,6% και 46,1% αντίστοιχα, γεγονός που συσχετίζεται καλά με τα παρουσιαζόμενα στάδια απώλειας μάζας.
Πίνακας 2: Παράμετροι που προκύπτουν από την προσέγγιση με βάση το μοντέλο χρησιμοποιώντας ένα διαδοχικό μοντέλο τριών βημάτων n-οστής τάξης
| Παράμετρος | 1ο βήμα (Fn) | 2ο βήμα (Fn) | 3ο βήμα (Fn) |
|---|---|---|---|
| Log (PreExp) | 9.88 | 0.88 | 8.02 |
| EA (kJ/mol) | 101.3 | 30.7 | 116.6 |
| Σειρά αντίδρασης | 1.01 | 0.91 | 0.77 |
| Συνεισφορά (%) | 40.3 | 13.6 | 46.1 |
Συμπέρασμα
Ο μηχανισμός πυρόλυσης του ακετυλοσαλικυλικού οξέος που προτείνεται στη βιβλιογραφία είναι ένας μηχανισμός δύο σταδίων με ταυτόχρονη εξάτμιση των ενδιάμεσων προϊόντων [6]. Οι Gregory et al. διαπίστωσαν ότι το οξικό οξύ είναι η κύρια ένωση που απελευθερώνεται κατά το πρώτο στάδιο απώλειας μάζας. Επιπλέον, προτείνουν έναν μηχανισμό πυρόλυσης που σχηματίζει μια ποικιλία ολιγομερών, όπως υποδεικνύεται από τις ατομικές μονάδες μάζας (amu) που ανιχνεύονται με φασματομετρία μάζας (MS) [6][7]. Παράλληλα με την επιβεβαίωση ότι τα κύρια αέρια προϊόντα είναι το οξικό οξύ, το σαλικυλικό οξύ, η φαινόλη και το ακετυλοσαλικυλικό οξύ, χρησιμοποιήθηκε μια ακόμη πιο εξελιγμένη τεχνική σύζευξης TGA-GC-MS για τον διαχωρισμό και την ταυτοποίηση περαιτέρω προϊόντων πυρόλυσης [2]. Όλοι οι συγγραφείς αναφέρουν μια υπέρθεση της πυρόλυσης και της εξάτμισης μεταξύ 40% και 60% της προόδου της αντίδρασης.
Στην παρούσα εργασία, κατέστη δυνατή η εφαρμογή αυτών των αποτελεσμάτων σε μια κινητική προσέγγιση βάσει μοντέλου με ένα διαδοχικό μοντέλο τριών βημάτων n-οστής τάξης. Η καλή συσχέτιση μεταξύ πειραματικών δεδομένων και μαθηματικού μοντέλου επιβεβαιώνεται από τον συντελεστή συσχέτισης 0,99986. Οι τιμές για την ενέργεια ενεργοποίησης, για παράδειγμα, βρίσκονται σε καλή συμφωνία με τις τιμές που αναφέρονται στη βιβλιογραφία. Παρ' όλα αυτά, η βασισμένη στο μοντέλο προσέγγιση ενός διαδοχικού μοντέλου τριών βημάτων που εισάγεται εδώ είναι σίγουρα ένα βήμα πέρα από τις προσεγγίσεις χωρίς ισομεταβλητό μοντέλο που βασίζονται στους Ozawa-Flynn-Wall ή άλλους [6], μεταξύ άλλων, δεδομένου ότι τα κινητικά δεδομένα είναι διαθέσιμα ανεξάρτητα για κάθε επιμέρους βήμα της αντίδρασης.