
23.07.2020 by Dr. Gabriele Kaiser
L'importanza di Purity Determination dei prodotti farmaceutici
Il crescente numero di richiami di prodotti negli ultimi mesi ci ha fatto capire ancora una volta quanto sia importante la purezza degli ingredienti dei farmaci. La calorimetria differenziale a scansione (DSC) è in grado di analizzare rapidamente la purezza assoluta dei composti chimici in un unico ciclo, senza la necessità di uno standard di riferimento.
Il crescente numero di richiami di prodotti negli ultimi mesi ci ha fatto capire ancora una volta quanto sia importante la purezza degli ingredienti dei farmaci. La presenza di sostanze chimiche indesiderate, anche in small quantità, può influire sull'efficacia e sulla sicurezza dei prodotti farmaceutici. Per il controllo della purezza vengono impiegate diverse tecniche analitiche. Tra queste, la calorimetria differenziale a scansione (DSC) è in grado di analizzare rapidamente la purezza assoluta dei composti chimici in un unico ciclo, senza la necessità di uno standard di riferimento.
Che cos'è un'impurità e da dove viene?
Secondo le linee guida ICH (ICH = International Council for Harmonization of Technical Requirements for Pharmaceuticals for Human Use), un'impurità è "qualsiasi componente ... che non è l'entità chimica definita come sostanza attiva o eccipiente nel prodotto". Le impurità sono classificate come:
- Impurezze organiche
- Impurità inorganiche
- Solventi residui
Le impurità organiche possono derivare da materiali di partenza, intermedi sintetici, sottoprodotti o prodotti di Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione. Le impurità inorganiche possono derivare dal processo di produzione e comprendono catalizzatori, coadiuvanti di filtrazione, sali inorganici, reagenti, ecc. I solventi residui sono, come dice il nome, residui di liquidi inorganici o organici applicati. Di questo elenco, il numero di impurità inorganiche e di solventi residui è solitamente limitato. Inoltre, sono normalmente noti e possono essere facilmente identificati. La situazione è invece diversa per le impurità organiche. Il loro numero è quasi illimitato e la loro natura dipende fortemente dalle condizioni di reazione della sintesi, dalle proprietà delle materie prime, ecc
Purity Determination Secondo USP <891> e Ph. Eur. 2.2.34
Il capitolo <891> della Farmacopea statunitense e il capitolo 2.2.34 della Farmacopea europea si occupano di analisi termica. La quantità totale di impurezze che fondono insieme al componente principale (chiamate anche impurezze eutettiche) può essere studiata analizzando il profilo del picco diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione corrispondente. Il calcolo si basa sul fatto che un contenuto crescente di impurezze porta a un allargamento dell'effetto diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione. Inoltre, il picco si sposta verso valori di temperatura più bassi (legge di Van't Hoff della depressione del Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione dei sistemi eutettici, vedi fig. 1).
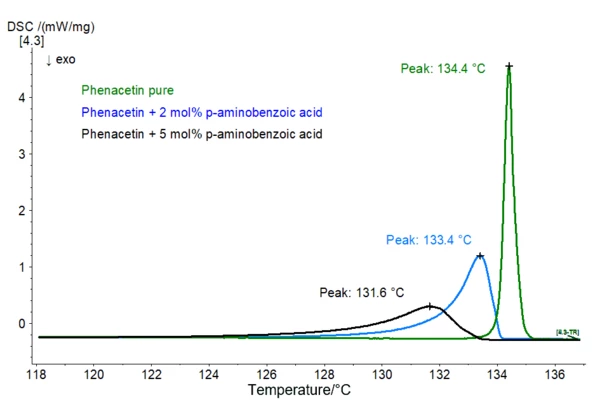
Fig. 1: Confronto degli effetti diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione di fenacetina pura (verde), fenacetina + 2 mol% di acido p-aminobenzoico (blu) e fenacetina + 5 mol% di acido p-aminobenzoico; masse dei campioni: 1 - 1,3 mg, velocità di riscaldamento: 1 K/min, crogioli di Al, atmosfera di N2 Maggiori informazioni sull'equazione di Van't Hoff e sul modo di determinare la purezza sono disponibili qui. Il presupposto per l'applicazione di questo metodo è che non si formino soluzioni solide, cioè che le impurità siano solubili solo nella fase liquida, ma non in quella solida. Inoltre, per ottenere risultati affidabili, occorre considerare i seguenti aspetti:
- Le sostanze devono avere una purezza superiore al 98,5% (USP <891>) o al 98% (Ph. Eur. 2.2.34)
- I materiali devono essere cristallini (non amorfi o parzialmente amorfi)
- I materiali non devono decomporsi durante laTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione
- I composti che esistono in forma polimorfa devono essere completamente convertiti in un'unica forma
- Le impurezze derivanti dalla sintesi possono avere una forma o una dimensione simile a quella del componente principale e quindi inserirsi nella sua matrice senza interrompere il reticolo. Tali impurità non sono rilevabili con la DSC.
Oltre a quanto descritto nelle farmacopee citate, esiste anche uno standard ASTM (ASTM E928) che descrive in dettaglio come determinare la purezza di composti termicamente stabili con temperature diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione ben definite utilizzando la DSC. Leggete anche il mio articolo su purity determination nel prossimo blog! Letteratura: (1) ICH Topic Q 3 A (R2), Impurities in new Drug Substances, EMEA, ottobre 2006