
23.07.2020 by Dr. Gabriele Kaiser
Znaczenie strony Purity Determination produktów farmaceutycznych
Rosnąca w ostatnich miesiącach liczba przypadków wycofywania produktów z rynku ponownie uświadomiła nam, jak ważna jest czystość składników leków. Różnicowa kalorymetria skaningowa (DSC) jest w stanie szybko przeanalizować absolutną czystość związków chemicznych w jednym cyklu, bez konieczności stosowania wzorca odniesienia.
Rosnąca w ostatnich miesiącach liczba przypadków wycofywania produktów z rynku ponownie uświadomiła nam, jak ważna jest czystość składników leków. Obecność niepożądanych substancji chemicznych, nawet w ilościach small, może mieć wpływ na skuteczność i bezpieczeństwo produktów farmaceutycznych. Do kontroli czystości stosowane są różne techniki analityczne. Wśród nich, różnicowa kalorymetria skaningowa (DSC) jest w stanie szybko przeanalizować absolutną czystość związków chemicznych w jednym cyklu, bez konieczności stosowania wzorca odniesienia.
Czym jest zanieczyszczenie i skąd się bierze?
Zgodnie z wytycznymi ICH (ICH = International Council for Harmonization of Technical Requirements for Pharmaceuticals for Human Use), zanieczyszczenie to "każdy składnik ... który nie jest jednostką chemiczną zdefiniowaną jako substancja czynna lub substancja pomocnicza w produkcie". Zanieczyszczenia są klasyfikowane jako
- Zanieczyszczenia organiczne
- Zanieczyszczenia nieorganiczne
- Pozostałości rozpuszczalników
Zanieczyszczenia organiczne mogą pochodzić z materiałów wyjściowych, syntetycznych półproduktów, produktów ubocznych lub produktów rozkładu. Zanieczyszczenia nieorganiczne mogą pochodzić z procesu produkcyjnego i obejmować katalizatory, substancje pomocnicze w filtrach, sole nieorganiczne, odczynniki itp. Rozpuszczalniki resztkowe to - jak sama nazwa wskazuje - pozostałości stosowanych cieczy nieorganicznych lub organicznych. Z tej listy liczba zanieczyszczeń nieorganicznych i pozostałości rozpuszczalników jest zwykle ograniczona. Zwykle są one znane i można je łatwo zidentyfikować. Sytuacja wygląda jednak inaczej w przypadku zanieczyszczeń organicznych. Ich liczba jest prawie nieograniczona, a ich charakter silnie zależy od warunków reakcji syntezy, właściwości surowców itp
Purity Determination Zgodnie z USP <891> i Ph. Eur. 2.2.34
Rozdział <891> Farmakopei Amerykańskiej oraz rozdział 2.2.34 Farmakopei Europejskiej dotyczą analizy termicznej. Całkowitą ilość zanieczyszczeń, które topią się razem z głównym składnikiem (zwanym również zanieczyszczeniami eutektycznymi) można zbadać, analizując profil odpowiedniego piku topnienia. Obliczenia opierają się na fakcie, że rosnąca zawartość zanieczyszczeń prowadzi do poszerzenia efektu topnienia. Dodatkowo, pik jest przesunięty do niższych wartości temperatury (prawo Van´t Hoffa obniżania temperatury topnienia układów eutektycznych, patrz rys. 1).
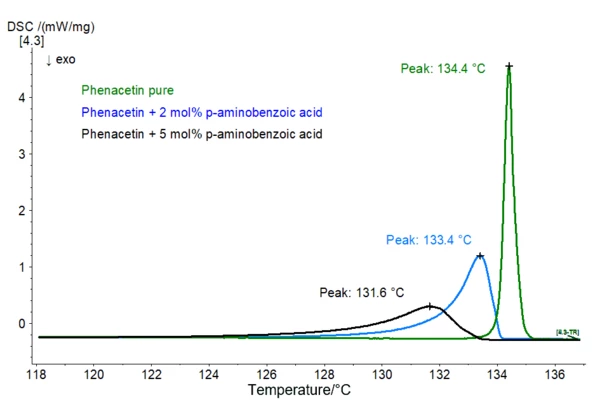
Rys. 1: Porównanie efektów topnienia czystej fenacetyny (zielony), fenacetyny + 2 mol% kwasu p-aminobenzoesowego (niebieski) i fenacetyny + 5 mol% kwasu p-aminobenzoesowego; Masy próbek: 1 do 1,3 mg, szybkość ogrzewania: 1 K/min, tygle Al, atmosfera N2 Więcej informacji na temat równania Van´t Hoffa i sposobu określania czystości można znaleźć tutaj. Warunkiem wstępnym zastosowania tej metody jest to, że nie tworzy się roztwór stały, tj. zanieczyszczenia są rozpuszczalne tylko w fazie ciekłej, ale nie w fazie stałej. Ponadto, aby uzyskać wiarygodne wyniki, należy wziąć pod uwagę następujące aspekty:
- Substancje powinny mieć czystość większą niż 98,5% (USP <891>) lub 98% (Ph. Eur. 2.2.34)
- Materiały powinny być krystaliczne (nie amorficzne lub częściowo amorficzne)
- Materiały nie powinny rozkładać się podczas topienia
- Związki występujące w formie polimorficznej powinny być całkowicie przekształcone w jedną formę
- Zanieczyszczenia pochodzące z syntezy mogą mieć podobny kształt lub rozmiar jak główny składnik, a tym samym pasować do jego matrycy bez zakłócania sieci. Takie zanieczyszczenia nie są wykrywalne przez DSC.
Oprócz opisu we wspomnianych farmakopeach istnieje również norma ASTM (ASTM E928), która szczegółowo opisuje sposób określania czystości stabilnych termicznie związków o dobrze zdefiniowanych temperaturach topnienia za pomocą DSC. Przeczytaj także mój artykuł na purity determination w nadchodzącym blogu! Literatura: (1) ICH Topic Q 3 A (R2), Zanieczyszczenia w nowych substancjach leczniczych, EMEA, październik 2006 r