Introdução
Na farmácia, dificilmente existe um ingrediente ativo sobre o qual se tenha escrito mais do que sobre o ácido acetilsalicílico (ou ASA; nos países de língua inglesa, até mesmo o nome comercial Aspirin™ é frequentemente usado como sinônimo). Sua história de sucesso começou no final do século 19, quando o Dr. Felix Hoffmann sintetizou a substância nos laboratórios da BAYER pela primeira vez sem impurezas. Atualmente, ainda é um dos produtos farmacêuticos mais populares usados em uma ampla faixa terapêutica. Pertence ao grupo dos antiinflamatórios não esteroidais (AINEs) e é indicado para o tratamento de dor, febre e inflamação. Além disso, é usado para prevenir a recorrência de ataques cardíacos ou derrames em pacientes de alto risco. Em 1977, o AAS foi adicionado como analgésico à "lista de medicamentos essenciais" da OMS (Organização Mundial da Saúde). [1]
Esta é uma das quatro notas de aplicação que examinam com mais detalhes o comportamento térmico do ácido acetilsalicílico: Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição em diferentes atmosferas de gás, cinética de Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição e as espécies de gás resultantes.
Tabela 1: Parâmetros de medição
| Parâmetro | Ácido acetilsalicílico |
| Massa da amostra | Aprox. 5 mg |
| Atmosfera | Argônio, nitrogênio e hélio |
| Cadinho | Al2O3, 85 μl, aberto |
| Programa de temperatura | RT a 600°C |
| Taxa de fluxo | 40 ml/min |
| Suporte de amostra | TGA, Tipo P |
Experimental
O material de amostra, ácido acetilsalicílico (CAS: 50-78-2), foi adquirido da Sigma Aldrich com pureza superior a 99%. É um pó branco e cristalino que existe em três modificações de cristal [2]. A forma I, com um Temperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica).ponto de fusão de aproximadamente 137°C [4], é a mais estável em temperatura ambiente e acima [3].
Os experimentos de PiróliseA pirólise é a decomposição térmica de compostos orgânicos em uma atmosfera inerte.pirólise geralmente são realizados em uma atmosfera de nitrogênio devido à sua disponibilidade e preço comparativamente baixo. Isso também se reflete em várias publicações, por exemplo, [5] e [6]. Para responder à pergunta se os resultados obtidos com nitrogênio também podem ser generalizados para outras atmosferas, foi realizada uma série experimental para estudar o comportamento térmico do ácido acetilsalicílico em função da natureza do gás de purga. Além do nitrogênio, outras atmosferas de gás inerte usadas foram hélio e argônio. Os parâmetros de medição correspondentes estão resumidos na tabela 1.
Para a caracterização do comportamento térmico, foi utilizado um instrumento NETZSCH TG 209 F1 .
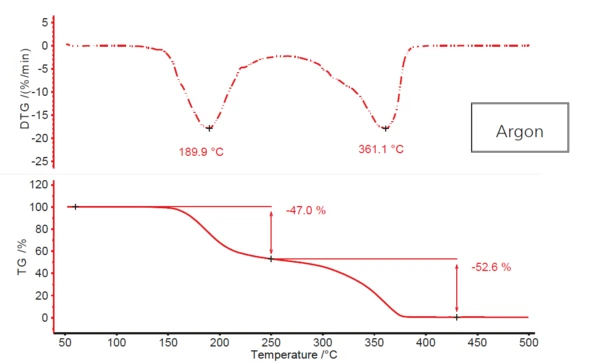
A Figura 1 mostra o perfil típico de Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição em duas etapas do ácido acetilsalicílico, resultante do aquecimento da substância em uma atmosfera de fluxo de argônio. A primeira etapa, com uma temperatura de pico de DTG de aproximadamente 190°C, apresenta uma perda de massa de 47%; a segunda etapa, a 361°C (novamente a temperatura de pico de DTG), apresenta quase 53%. Entretanto, não ocorre um platô real entre as duas etapas de perda de massa. A primeira se funde, mais ou menos, com a segunda. Isso indica que talvez mais de duas etapas de Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição estejam envolvidas. A possibilidade de que um mecanismo mais complexo como esse seja o caso aqui é apoiada pelo fato de que o segundo pico de DTG tem um ombro claramente visível a aproximadamente 320°C na inclinação descendente.
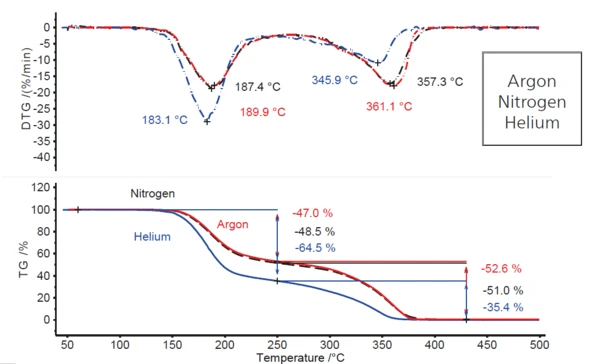
Comparando a situação em uma atmosfera de argônio com experimentos realizados com taxas de aquecimento idênticas em atmosferas de nitrogênio e hélio (Figura 2), o comportamento sob condições de nitrogênio é praticamente o mesmo que em argônio, enquanto muda significativamente sob uma atmosfera de hélio em fluxo. Observa-se um aumento na primeira etapa de perda de massa de cerca de 18 pontos percentuais (de 47% para quase 65%) e, consequentemente, uma diminuição na segunda etapa de perda de massa da mesma quantidade (de 53% para 35%). Além disso, ambas as etapas de perda de massa são deslocadas para temperaturas um pouco mais baixas, o que é indicado pela diminuição das temperaturas específicas do pico de DTG (4 K a 7 K para o primeiro pico de DTG e 11 K a 15 K para o segundo). Isso sugere que algo diferente está acontecendo em uma atmosfera de hélio do que em atmosferas de argônio e nitrogênio.
Na literatura, um mecanismo de duas etapas com evaporação simultânea de intermediários é proposto como o mecanismo de PiróliseA pirólise é a decomposição térmica de compostos orgânicos em uma atmosfera inerte.pirólise do ácido acetilsalicílico [7]. As medições conduzidas pelo site NETZSCH em uma atmosfera de nitrogênio e hélio usando técnicas hifenizadas, mais precisamente, TGA/STA em combinação com FT-IR [6] e GC-MS [8], apoiam essa hipótese. Isso indica que a natureza dos produtos de Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição é independente da atmosfera de gás.
A principal diferença entre todos esses experimentos é a DensidadeA densidade de massa é definida como a relação entre massa e volume. densidade do gás de purga usado (consulte a tabela 2). Ela difere ao máximo por um fator de 10.
Isso sugere que uma DensidadeA densidade de massa é definida como a relação entre massa e volume. densidade maior do gás de purga cria uma contrapressão maior, o que resulta em uma transferência reduzida dos componentes voláteis da amostra para a atmosfera de gás. Esse efeito é particularmente visível quando se usa hélio, que tem uma DensidadeA densidade de massa é definida como a relação entre massa e volume. densidade muito menor do que o nitrogênio ou o argônio. Como as verdadeiras Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. reações de decomposição são independentes da atmosfera de gás inerte circundante [10], talvez a evaporação paralela seja a mais afetada.
O fato de a decomposição ocorrer em temperaturas ligeiramente mais baixas no hélio (por exemplo, pico de DTG a 183 °C em comparação com 187 °C no nitrogênio e aproximadamente 190 °C no argônio) deve-se à maior Condutividade térmicaA condutividade térmica (λ com a unidade W/(m-K)) descreve o transporte de energia - na forma de calor - por um corpo de massa como resultado de um gradiente de temperatura (veja a fig. 1). De acordo com a segunda lei da termodinâmica, o calor sempre flui na direção da temperatura mais baixa.condutividade térmica desse gás (consulte a tabela 3). Na faixa de temperatura em que a radiação térmica desempenha apenas um papel secundário, a amostra atinge a temperatura de reação em um gás de purga com maior Condutividade térmicaA condutividade térmica (λ com a unidade W/(m-K)) descreve o transporte de energia - na forma de calor - por um corpo de massa como resultado de um gradiente de temperatura (veja a fig. 1). De acordo com a segunda lei da termodinâmica, o calor sempre flui na direção da temperatura mais baixa.condutividade térmica um pouco mais cedo.
Tabela 2: Valores de DensidadeA densidade de massa é definida como a relação entre massa e volume. densidade a 0°C e pressão normal de vários gases de purga
| Gás | DensidadeA densidade de massa é definida como a relação entre massa e volume. Densidade / (g/cm³) [9] |
| Hélio | 0.178 |
| Nitrogênio | 1.251 |
| Argônio | 1.784 |
Tabela 3: Valores de Condutividade térmicaA condutividade térmica (λ com a unidade W/(m-K)) descreve o transporte de energia - na forma de calor - por um corpo de massa como resultado de um gradiente de temperatura (veja a fig. 1). De acordo com a segunda lei da termodinâmica, o calor sempre flui na direção da temperatura mais baixa.condutividade térmica sob condições padrão de vários gases de purga
| Gás | |
| Hélio | 0.1567 |
| Nitrogênio | 0.0260 |
| Argônio | 0.0179 |
Conclusão
selectO presente exemplo mostra que a atmosfera do gás de purga pode ter um forte impacto sobre os resultados da medição termogravimétrica, mesmo que o gás de purga não atue como um parceiro de reação. Uma DensidadeA densidade de massa é definida como a relação entre massa e volume. densidade de gás muito variável pode ter um efeito sobre a transferência de compostos gasosos da superfície da amostra para a atmosfera de gás circundante, especialmente se houver evaporação.