مقدمة
في مجال الصيدلة، لا يكاد يوجد أي مكون نشط كُتب عنه أكثر مما كُتب عن حمض أسيتيل الساليسيليك (أو ASA اختصارًا؛ وفي البلدان الناطقة بالإنجليزية غالبًا ما يُستخدم الاسم التجاري Aspirin™ كمرادف له). وقد بدأت قصة نجاحه في نهاية القرن التاسع عشر عندما قام الدكتور فيليكس هوفمان بتصنيع هذه المادة في مختبرات باير لأول مرة بدون شوائب. في الوقت الحاضر، لا يزال أحد أكثر المستحضرات الصيدلانية شيوعًا المستخدمة في نطاق علاجي واسع. وهو ينتمي إلى مجموعة العقاقير غير الستيرويدية المضادة للالتهابات (NSAIDs) ويستخدم لعلاج الألم والحمى والالتهابات. بالإضافة إلى ذلك، يُستخدم للوقاية من تكرار النوبة القلبية أو السكتة الدماغية لدى المرضى المعرضين لخطر الإصابة. في عام 1977، تمت إضافة ASA كمسكن إلى "قائمة الأدوية الأساسية" لمنظمة الصحة العالمية (منظمة الصحة العالمية). [1]
هذه واحدة من أربع مذكرات تطبيقية تدرس بمزيد من التفصيل السلوك الحراري لحمض أسيتيل الساليسيليك: التحلل في أجواء غازية مختلفة، وحركية التحلل، وأنواع الغازات الناتجة.
الجدول 1: معلمات القياس
| المعلمة | حمض أسيتيل الساليسيليك |
| كتلة العينة | حوالي 5 مجم |
| الغلاف الجوي | الأرجون والنيتروجين والهيليوم |
| بوتقة | Al2O3، 85 ميكرولتر، مفتوح |
| برنامج درجة الحرارة | RT إلى 600 درجة مئوية |
| معدل التدفق | 40 مل/دقيقة |
| حامل العينة | TGA، النوع P |
تجريبي
تم الحصول على مادة العينة، وهي حمض أسيتيل الساليسيليك (CAS: 50-78-2)، من شركة سيجما ألدريتش بنقاء يزيد عن 99%. وهو عبارة عن مسحوق بلوري أبيض اللون موجود في ثلاثة أشكال بلورية [2]. الشكل الأول، الذي تبلغ درجة انصهاره حوالي 137 درجة مئوية [4]، هو الأكثر استقرارًا في درجة الحرارة المحيطة وما فوقها [3].
عادةً ما تُجرى تجارب الانحلال الحراري في جو من النيتروجين نظرًا لتوافره وسعره المنخفض نسبيًا. وينعكس هذا أيضًا في العديد من المنشورات، على سبيل المثال [5] و[6]. للإجابة على سؤال حول ما إذا كان يمكن أيضًا تعميم النتائج التي تم الحصول عليها في ظل النيتروجين على الأجواء الأخرى، تم إجراء سلسلة تجريبية لدراسة السلوك الحراري لحمض أسيتيل الساليسيليك كدالة لطبيعة غاز التطهير. إلى جانب النيتروجين، كانت أجواء الغازات الخاملة الأخرى المستخدمة هي الهيليوم والأرجون. تم تلخيص معلمات القياس المقابلة في الجدول 1.
لتوصيف السلوك الحراري، تم استخدام جهاز NETZSCH TG 209 F1 لتوصيف السلوك الحراري.
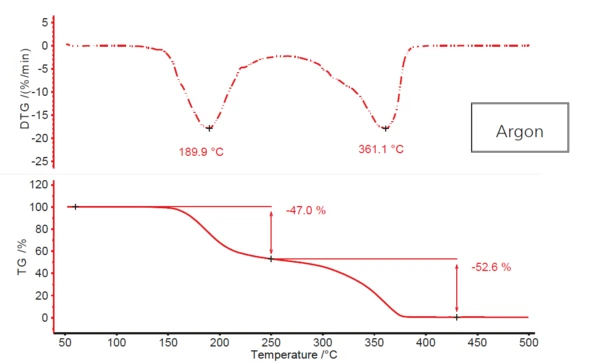
يصور الشكل 1 ملف التحلل النموذجي لحمض أسيتيل الساليسيليك على خطوتين، الناتج عن تسخين المادة في جو الأرجون المتدفق. تُظهِر الخطوة الأولى، مع درجة حرارة ذروة التحلل DTG تبلغ حوالي 190 درجة مئوية، فقدان كتلة بنسبة 47%؛ أما الخطوة الثانية، عند 361 درجة مئوية (درجة حرارة ذروة التحلل DTG أيضًا)، فتظهر ما يقرب من 53%. ومع ذلك، لا يحدث استقرار حقيقي بين خطوتي فقدان الكتلة. تندمج الأولى، بشكل أو بآخر، في الثانية. وهذا يشير إلى احتمال وجود أكثر من خطوتين للتحلل. وبالإضافة إلى ذلك، فإن احتمال وجود آلية أكثر تعقيدًا مثل هذه هي الحالة هنا تدعمها حقيقة أن قمة التحلل الكتلي الثانية لها كتف واضح للعيان عند درجة حرارة 320 درجة مئوية تقريبًا في المنحدر الهابط.
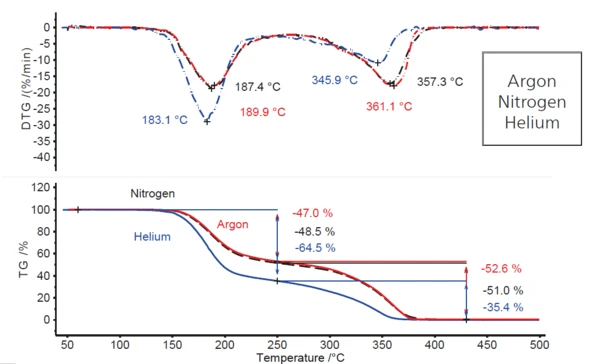
وبمقارنة الوضع في الغلاف الجوي للأرغون بالتجارب التي أُجريت بمعدلات تسخين متطابقة في كل من غلاف النيتروجين والهيليوم (الشكل 2)، فإن السلوك في ظروف النيتروجين هو نفسه تقريبًا كما في الأرجون، بينما يتغير بشكل ملحوظ في ظل غلاف الهيليوم المتدفق. لوحظت زيادة في خطوة فقدان الكتلة الأولى بحوالي 18 نقطة مئوية (من 47% إلى 65% تقريبًا)، وبالتالي لوحظ انخفاض في خطوة فقدان الكتلة الثانية بنفس المقدار (من 53% إلى 35%). وبالإضافة إلى ذلك، تنتقل كلتا خطوتي فقدان الكتلة إلى درجات حرارة منخفضة إلى حد ما، وهو ما يشير إليه الانخفاض في درجات حرارة ذروة DTG المحددة (من 4 كلفن إلى 7 كلفن لذروة DTG الأولى ومن 11 كلفن إلى 15 كلفن للثانية). وهذا يشير إلى أن شيئًا مختلفًا يحدث في الغلاف الجوي للهيليوم عنه في أجواء الأرجون والنيتروجين.
في الأدبيات، تم اقتراح آلية من خطوتين مع التبخر المتزامن للمواد الوسيطة كآلية للتحلل الحراري لحمض أسيتيل الساليسيليك [7]. تدعم هذه الفرضية القياسات التي أجرتها شركة NETZSCH في جو النيتروجين وكذلك في جو الهيليوم باستخدام تقنيات الوصلة، وبشكل أكثر دقة، TGA/STA بالاشتراك مع FT-IR [6] وGC-MS [8]. وهذا يشير إلى أن طبيعة نواتج التحلل مستقلة عن الغلاف الجوي الغازي.
يتمثل الاختلاف الرئيسي بين جميع هذه التجارب في كثافة غاز التطهير المستخدم (انظر الجدول 2). فهو يختلف إلى أقصى حد بمعامل 10.
يشير هذا إلى أن الكثافة الأعلى لغاز التطهير تخلق ضغطًا خلفيًا أعلى، مما يؤدي إلى انخفاض انتقال مكونات العينة المتطايرة إلى جو الغاز. ويظهر هذا التأثير بشكل خاص عند استخدام الهيليوم، الذي له كثافة أقل بكثير من النيتروجين أو الأرجون. وبما أن تفاعلات التحلل الحقيقية مستقلة عن الغلاف الجوي للغاز الخامل المحيط [10]، فربما يكون التبخر الموازي هو الأكثر تأثرًا.
وحقيقة أن التحلل يحدث عند درجات حرارة أقل قليلًا في الهيليوم (على سبيل المثال، ذروة التحلل عند 183 درجة مئوية مقارنة بـ 187 درجة مئوية في النيتروجين وحوالي 190 درجة مئوية في الأرجون) ترجع إلى التوصيلية الحرارية الأعلى لهذا الغاز (انظر الجدول 3). في نطاق درجة الحرارة حيث يلعب الإشعاع الحراري دورًا ثانويًا فقط، تصل العينة إلى درجة حرارة التفاعل في غاز التطهير ذي الموصلية الحرارية الأعلى في وقت مبكر إلى حد ما.
الجدول 2: قيم الكثافة عند درجة حرارة صفر درجة مئوية والضغط العادي لغازات التطهير المختلفة
| الغاز | الكثافة / (جم/سم مكعب) [9] |
| الهيليوم | 0.178 |
| النيتروجين | 1.251 |
| الأرجون | 1.784 |
الجدول 3: قيم التوصيل الحراري في ظل الظروف القياسية لغازات التطهير المختلفة
| الغاز | الموصلية الحرارية (وات/م-ك) [11] |
| الهيليوم | 0.1567 |
| النيتروجين | 0.0260 |
| الأرجون | 0.0179 |
الخاتمة
ويوضح المثال الحالي أن جو الغاز المختار قد يكون له تأثير قوي على نتائج قياس الثقل الحراري، حتى إذا كان غاز التطهير لا يعمل كشريك في التفاعل. يمكن أن يكون لكثافة الغاز المتفاوتة بشكل كبير تأثير على انتقال المركبات الغازية من سطح العينة إلى الغلاف الجوي للغاز المحيط بها - خاصةً إذا كان هناك تبخر.