Wprowadzenie
W farmacji nie ma prawie żadnego aktywnego składnika, o którym napisano by więcej niż o kwasie acetylosalicylowym (lub w skrócie ASA; w krajach anglojęzycznych nawet nazwa marki Aspirin™ jest często używana jako synonim). Historia jego sukcesu rozpoczęła się pod koniec XIX wieku, kiedy dr Felix Hoffmann po raz pierwszy zsyntetyzował tę substancję w laboratoriach BAYER bez zanieczyszczeń. Obecnie jest to nadal jeden z najpopularniejszych farmaceutyków stosowanych w szerokim zakresie terapeutycznym. Należy do grupy niesteroidowych leków przeciwzapalnych (NLPZ) i jest wskazany w leczeniu bólu, gorączki i stanów zapalnych. Ponadto jest stosowany w zapobieganiu nawrotom zawału serca lub udaru mózgu u pacjentów z grupy wysokiego ryzyka. W 1977 roku ASA został dodany jako lek przeciwbólowy do "listy podstawowych leków" WHO (Światowej Organizacji Zdrowia). [1]
Jest to jedna z czterech not aplikacyjnych, które bardziej szczegółowo analizują zachowanie termiczne kwasu acetylosalicylowego: rozkład w różnych atmosferach gazowych, kinetykę rozkładu i powstające gatunki gazów.
Tabela 1: Parametry pomiaru
| Parametr | Kwas acetylosalicylowy |
| Masa próbki | Około 5 mg |
| Atmosfera | Argon, azot i hel |
| Tygiel | Al2O3, 85 μl, otwarty |
| Program temperatury | RT do 600°C |
| Przepływ | 40 ml/min |
| Uchwyt próbki | TGA, typ P |
Eksperymentalny
Materiał próbki, kwas acetylosalicylowy (CAS: 50-78-2), został zakupiony od Sigma Aldrich z czystością > 99%. Jest to biały, krystaliczny proszek, który występuje w trzech modyfikacjach krystalicznych [2]. Forma I, o temperaturze topnienia około 137°C [4], jest najbardziej stabilna w temperaturze otoczenia i wyższej [3].
Eksperymenty pirolizy są zwykle przeprowadzane w atmosferze azotu ze względu na jego dostępność i stosunkowo niską cenę. Znajduje to również odzwierciedlenie w kilku publikacjach, na przykład [5] i [6]. Aby odpowiedzieć na pytanie, czy wyniki uzyskane w atmosferze azotu można również uogólnić na inne atmosfery, przeprowadzono serię eksperymentów w celu zbadania zachowania termicznego kwasu acetylosalicylowego w funkcji rodzaju gazu oczyszczającego. Oprócz azotu, zastosowano również inne atmosfery gazów obojętnych: hel i argon. Odpowiednie parametry pomiarowe podsumowano w tabeli 1.
Do scharakteryzowania zachowania termicznego zastosowano przyrząd NETZSCH TG 209 F1 .
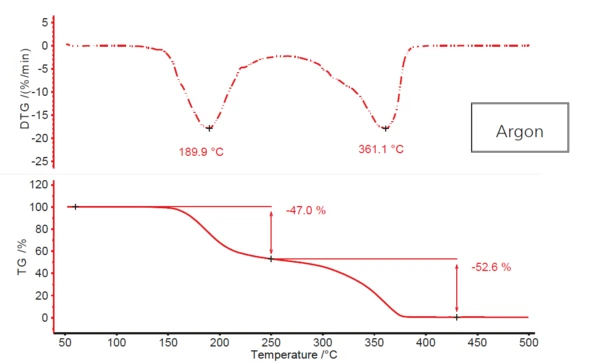
Rysunek 1 przedstawia typowy dwuetapowy profil rozkładu kwasu acetylosalicylowego, wynikający z ogrzewania substancji w przepływającej atmosferze argonu. Pierwszy etap, z temperaturą szczytową DTG około 190°C, wykazuje ubytek masy 47%; drugi etap, w temperaturze 361°C (ponownie temperatura szczytowa DTG), wykazuje prawie 53%. Jednak pomiędzy tymi dwoma etapami utraty masy nie występuje prawdziwe plateau. Pierwszy z nich łączy się mniej więcej z drugim. Wskazuje to, że w grę mogą wchodzić więcej niż dwa etapy rozkładu. Możliwość, że w tym przypadku mamy do czynienia z bardziej złożonym mechanizmem, jest dodatkowo poparta faktem, że drugi pik DTG ma wyraźnie widoczne ramię przy ok. 320°C na opadającym zboczu.
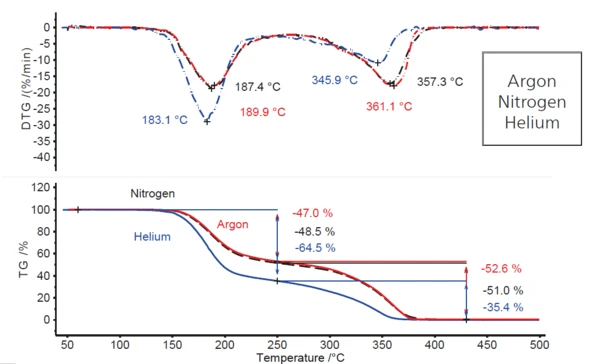
Porównując sytuację w atmosferze argonu z eksperymentami przeprowadzonymi przy identycznych szybkościach ogrzewania zarówno w atmosferze azotu, jak i helu (rysunek 2), zachowanie w warunkach azotu jest mniej więcej takie samo jak w argonie, podczas gdy zmienia się znacząco w przepływającej atmosferze helu. Zaobserwowano wzrost pierwszego stopnia utraty masy o około 18 punktów procentowych (z 47% do prawie 65%), a w konsekwencji spadek drugiego stopnia utraty masy o tę samą wartość (z 53% do 35%). Ponadto oba etapy utraty masy są przesunięte do nieco niższych temperatur, na co wskazuje spadek poszczególnych temperatur piku DTG (4 K do 7 K dla pierwszego piku DTG i 11 K do 15 K dla drugiego). Sugeruje to, że w atmosferze helu dzieje się coś innego niż w atmosferze argonu i azotu.
W literaturze jako mechanizm pirolizy kwasu acetylosalicylowego proponuje się mechanizm dwuetapowy z jednoczesnym odparowaniem półproduktów [7]. Pomiary przeprowadzone przez NETZSCH zarówno w atmosferze azotu, jak i helu przy użyciu technik łączonych, a dokładniej TGA/STA w połączeniu z FT-IR [6] i GC-MS [8], potwierdzają tę hipotezę. Wskazuje to, że charakter produktów rozkładu jest niezależny od atmosfery gazowej.
Główną różnicą między wszystkimi tymi eksperymentami jest gęstość użytego gazu oczyszczającego (patrz tabela 2). Różni się ona maksymalnie o współczynnik 10.
Sugeruje to, że wyższa gęstość gazu oczyszczającego tworzy wyższe przeciwciśnienie, co skutkuje zmniejszonym przenoszeniem lotnych składników próbki do atmosfery gazowej. Efekt ten jest szczególnie widoczny w przypadku stosowania helu, który ma znacznie mniejszą gęstość niż azot lub argon. Ponieważ prawdziwe Reakcja rozkładuReakcja rozkładu to wywołana termicznie reakcja związku chemicznego tworząca produkty stałe i/lub gazowe. reakcje rozkładu są niezależne od otaczającej atmosfery gazu obojętnego [10], być może największy wpływ ma równoległe parowanie.
Fakt, żeReakcja rozkładuReakcja rozkładu to wywołana termicznie reakcja związku chemicznego tworząca produkty stałe i/lub gazowe. rozkład zachodzi w nieco niższych temperaturach w helu (np. szczyt DTG przy 183°C w porównaniu do 187°C w azocie i ok. 190°C w argonie) wynika z wyższej przewodności cieplnej tego gazu (patrz tabela 3). W zakresie temperatur, w których promieniowanie cieplne odgrywa jedynie niewielką rolę, próbka osiąga temperaturę reakcji w gazie oczyszczającym o wyższej przewodności cieplnej nieco wcześniej.
Tabela 2: Wartości gęstości w temperaturze 0°C i przy normalnym ciśnieniu różnych gazów płuczących
| Gaz | Gęstość / (g/cm³) [9] |
| Hel | 0.178 |
| Azot | 1.251 |
| Argon | 1.784 |
Tabela 3: Wartości przewodności cieplnej różnych gazów płuczących w warunkach standardowych
| Gaz | |
| Hel | 0.1567 |
| Azot | 0.0260 |
| Argon | 0.0179 |
Wnioski
Niniejszy przykład pokazuje, że atmosfera gazu selected może mieć duży wpływ na wyniki pomiarów termograwimetrycznych, nawet jeśli gaz oczyszczający nie działa jako partner reakcji. Znacznie zmieniająca się gęstość gazu może mieć wpływ na przenoszenie związków gazowych z powierzchni próbki do otaczającej atmosfery gazowej - zwłaszcza jeśli zachodzi parowanie.