Introduzione
In farmacia non c'è quasi nessun principio attivo su cui si sia scritto di più dell'acido acetilsalicilico (o ASA in breve; nei paesi di lingua inglese anche il nome di marca Aspirin™ è spesso usato come sinonimo). La sua storia di successo è iniziata alla fine del XIX secolo, quando il Dr. Felix Hoffmann sintetizzò per la prima volta la sostanza nei laboratori BAYER senza impurità. Al giorno d'oggi, è ancora uno dei farmaci più popolari, utilizzato in un ampio spettro terapeutico. Appartiene al gruppo dei farmaci antinfiammatori non steroidei (FANS) ed è indicato per il trattamento di dolore, febbre e infiammazione. Inoltre, viene utilizzato per prevenire le recidive di infarto o ictus in pazienti ad alto rischio. Nel 1977, l'ASA è stato aggiunto come analgesico alla "lista dei farmaci essenziali" dell'OMS (Organizzazione Mondiale della Sanità). [1]
Questa è una delle quattro note applicative che esaminano più dettagliatamente il comportamento termico dell'acido acetilsalicilico: Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione in diverse atmosfere gassose, cinetica di Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione e specie gassose risultanti.
Tabella 1: Parametri di misura
| Parametro | Acido acetilsalicilico |
| Massa del campione | Circa 5 mg |
| Atmosfera | Argon, azoto ed elio |
| Crogiolo | Al2O3, 85 μl, aperto |
| Programma di temperatura | Da RT a 600°C |
| Velocità di flusso | 40 ml/min |
| Supporto del campione | TGA, tipo P |
Sperimentale
Il materiale del campione, l'acido acetilsalicilico (CAS: 50-78-2), è stato acquistato da Sigma Aldrich con una purezza > 99%. Si tratta di una polvere bianca e cristallina che esiste in tre modificazioni cristalline [2]. La forma I, con un Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione di circa 137°C [4], è la più stabile a temperatura ambiente e oltre [3].
Gli esperimenti di PirolisiLa pirolisi è la decomposizione termica di composti organici in atmosfera inerte.pirolisi vengono solitamente condotti in atmosfera di azoto a causa della sua disponibilità e del suo prezzo relativamente basso. Ciò si riflette anche in diverse pubblicazioni, ad esempio [5] e [6]. Per rispondere alla domanda se i risultati ottenuti in azoto possano essere generalizzati anche ad altre atmosfere, è stata eseguita una serie di esperimenti per studiare il comportamento termico dell'acido acetilsalicilico in funzione della natura del gas di lavaggio. Oltre all'azoto, le altre atmosfere di gas inerte utilizzate sono state l'elio e l'argon. I parametri di misura corrispondenti sono riassunti nella tabella 1.
Per la caratterizzazione del comportamento termico, è stato utilizzato uno strumento NETZSCH TG 209 F1 .
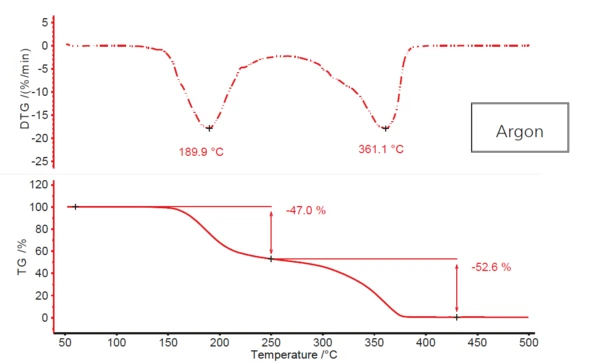
La Figura 1 illustra il tipico profilo di Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione in due fasi dell'acido acetilsalicilico, risultante dal riscaldamento della sostanza in atmosfera di argon. La prima fase, con una temperatura di picco DTG di circa 190°C, presenta una perdita di massa del 47%; la seconda fase, a 361°C (sempre temperatura di picco DTG), presenta quasi il 53%. Tuttavia, non si verifica un vero e proprio plateau tra le due fasi di perdita di massa. Il primo si fonde, più o meno, nel secondo. Ciò indica che forse sono coinvolte più di due fasi di Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione. La possibilità che si tratti di un meccanismo più complesso come questo è supportata anche dal fatto che il secondo picco DTG ha una spalla chiaramente visibile a circa 320°C nella pendenza discendente.
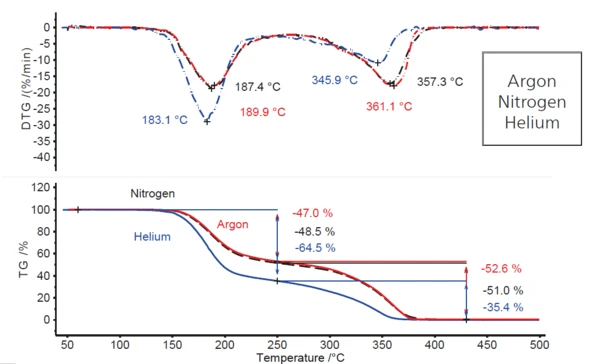
Confrontando la situazione in atmosfera di argon con esperimenti eseguiti con identiche velocità di riscaldamento in atmosfera di azoto ed elio (figura 2), il comportamento in condizioni di azoto è circa lo stesso di quello in argon, mentre cambia significativamente in atmosfera di elio fluente. Si osserva un aumento della prima fase di perdita di massa di circa 18 punti percentuali (dal 47% a quasi il 65%) e, di conseguenza, una diminuzione della seconda fase di perdita di massa della stessa entità (dal 53% al 35%). Inoltre, entrambe le fasi di perdita di massa sono spostate a temperature leggermente inferiori, come indicato dalla diminuzione delle temperature dei picchi DTG (da 4 K a 7 K per il primo picco DTG e da 11 K a 15 K per il secondo). Ciò suggerisce che in un'atmosfera di elio sta accadendo qualcosa di diverso rispetto alle atmosfere di argon e azoto.
In letteratura viene proposto come meccanismo di PirolisiLa pirolisi è la decomposizione termica di composti organici in atmosfera inerte.pirolisi dell'acido acetilsalicilico un meccanismo a due fasi con evaporazione simultanea degli intermedi [7]. Le misure condotte da NETZSCH in atmosfera di azoto e di elio, utilizzando tecniche sdoppiate, più precisamente TGA/STA in combinazione con FT-IR [6] e GC-MS [8], supportano questa ipotesi. Ciò indica che la natura dei prodotti di Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione è indipendente dall'atmosfera del gas.
La differenza principale tra tutti questi esperimenti è la densità del gas di lavaggio utilizzato (vedi tabella 2). La differenza massima è di 10 volte.
Ciò suggerisce che una maggiore densità del gas di lavaggio crea una contropressione più elevata, che si traduce in un ridotto trasferimento dei componenti volatili del campione nell'atmosfera gassosa. Questo effetto è particolarmente visibile quando si utilizza l'elio, che ha una densità molto più bassa dell'azoto o dell'argon. Poiché le vere Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. reazioni di decomposizione sono indipendenti dall'atmosfera del gas inerte circostante [10], è forse l'evaporazione parallela a essere maggiormente influenzata.
Il fatto che la Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione avvenga a temperature leggermente inferiori nell'elio (ad esempio, il picco DTG a 183°C rispetto ai 187°C dell'azoto e ai circa 190°C dell'argon) è dovuto alla maggiore conducibilità termica di questo gas (vedere tabella 3). Nell'intervallo di temperatura in cui l'irraggiamento termico gioca solo un ruolo secondario, il campione raggiunge la temperatura di reazione in un gas di lavaggio con Conduttività termicaLa conducibilità termica (λ con unità di misura W/(m-K)) descrive il trasporto di energia - sotto forma di calore - attraverso un corpo di massa come risultato di un gradiente di temperatura (vedi fig. 1). Secondo la seconda legge della termodinamica, il calore fluisce sempre nella direzione della temperatura più bassa.conduttività termica più elevata un po' prima.
Tabella 2: Valori di densità a 0°C e pressione normale di vari gas di lavaggio
| Gas | Densità / (g/cm³) [9] |
| Elio | 0.178 |
| Azoto | 1.251 |
| Argon | 1.784 |
Tabella 3: Valori di conducibilità termica in condizioni standard dei vari gas di lavaggio
| Gas | |
| Elio | 0.1567 |
| Azoto | 0.0260 |
| Argon | 0.0179 |
Conclusione
Il presente esempio dimostra che l'atmosfera del gas selectpuò avere un forte impatto sui risultati della misurazione termogravimetrica, anche se il gas di lavaggio non agisce come partner di reazione. Una densità del gas molto variabile può avere un effetto sul trasferimento dei composti gassosi dalla superficie del campione all'atmosfera gassosa circostante, soprattutto se si tratta di evaporazione.