Giriş
Eczacılıkta, hakkında asetilsalisilik asitten (ya da kısaca ASA; İngilizce konuşulan ülkelerde Aspirin™ markası bile sıklıkla eşanlamlı olarak kullanılmaktadır) daha fazla şey yazılan bir etken madde neredeyse yoktur. Başarı öyküsü 19. yüzyılın sonunda Dr. Felix Hoffmann'ın bu maddeyi BAYER laboratuvarlarında ilk kez safsızlık içermeyen bir şekilde sentezlemesiyle başlamıştır. Günümüzde hala geniş bir terapötik aralıkta kullanılan en popüler farmasötiklerden biridir. Steroid olmayan anti-enflamatuar ilaçlar (NSAID'ler) grubuna aittir ve ağrı, ateş ve enflamasyon tedavisinde endikedir. Ayrıca, yüksek riskli hastalarda kalp krizi veya inmenin tekrarlamasını önlemek için kullanılır. 1977 yılında ASA, WHO'nun (Dünya Sağlık Örgütü) "temel ilaç listesine" analjezik olarak eklenmiştir. [1]
Bu, asetilsalisilik asidin termal davranışını daha ayrıntılı olarak inceleyen dört uygulama notundan biridir: farklı gaz atmosferlerinde Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma, Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma kinetiği ve ortaya çıkan gaz türleri.
Tablo 1: Ölçüm parametreleri
| Parametre | Asetilsalisilik Asit |
| Örnek kütle | Yaklaşık 5 mg |
| Atmosfer | Argon, nitrojen ve helyum |
| Pota | Al2O3, 85 μl, açık |
| Sıcaklık programı | RT ila 600°C |
| Akış hızı | 40 ml/dak |
| Örnek tutucu | TGA, P Tipi |
Deneysel
Örnek materyal olan asetilsalisilik asit (CAS: 50-78-2), Sigma Aldrich'ten >%99 saflıkta temin edilmiştir. Üç kristal modifikasyonunda bulunan beyaz, kristal bir tozdur [2]. Erime noktası yaklaşık 137°C [4] olan Form I, ortam sıcaklığı ve üzerinde en kararlı olanıdır [3].
PirolizPiroliz, organik bileşiklerin inert bir atmosferde termal olarak ayrışmasıdır.Piroliz deneyleri, bulunabilirliği ve nispeten düşük fiyatı nedeniyle genellikle nitrojen atmosferinde gerçekleştirilir. Bu durum, örneğin [5] ve [6] gibi çeşitli yayınlarda da yansıtılmaktadır. Azot altında elde edilen sonuçların diğer atmosferlere de genelleştirilip genelleştirilemeyeceği sorusuna cevap vermek için, asetilsalisilik asidin termal davranışını temizleme gazı yapısının bir fonksiyonu olarak incelemek için bir deney serisi gerçekleştirilmiştir. Azotun yanı sıra kullanılan diğer inert gaz atmosferleri helyum ve argon olmuştur. İlgili ölçüm parametreleri tablo 1'de özetlenmiştir.
Termal davranışın karakterizasyonu için bir NETZSCH TG 209 F1 cihazı kullanılmıştır.
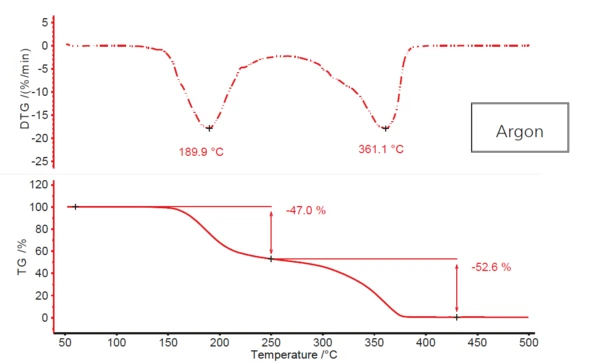
Şekil 1, maddenin akan argon atmosferinde ısıtılmasından kaynaklanan asetilsalisilik asidin tipik iki aşamalı Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma profilini göstermektedir. DTG pik sıcaklığı yaklaşık 190°C olan ilk adımda %47'lik bir kütle kaybı görülmektedir; 361°C'deki (yine DTG pik sıcaklığı) ikinci adımda ise neredeyse %53'lük bir kayıp görülmektedir. Ancak, iki kütle kaybı adımı arasında gerçek bir plato oluşmaz. Birincisi az ya da çok ikincisiyle birleşmektedir. Bu da ikiden fazla Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma adımının söz konusu olabileceğini göstermektedir. Bunun gibi daha karmaşık bir mekanizmanın burada söz konusu olabileceği olasılığı, ikinci DTG pikinin azalan eğimde yaklaşık 320°C'de açıkça görülebilen bir omuza sahip olmasıyla da desteklenmektedir.
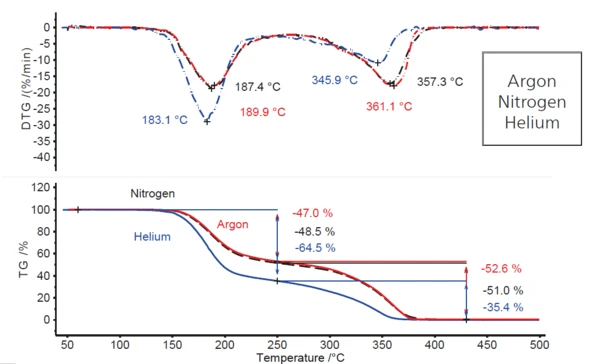
Argon atmosferindeki durum, hem nitrojen hem de helyum atmosferlerinde aynı ısıtma hızlarında gerçekleştirilen deneylerle karşılaştırıldığında (Şekil 2), nitrojen koşulları altındaki davranış argon ile hemen hemen aynı iken, akan helyum atmosferi altında önemli ölçüde değişmektedir. İlk kütle kaybı adımında yaklaşık yüzde 18 puanlık bir artış (%47'den neredeyse %65'e) ve sonuç olarak ikinci kütle kaybı adımında aynı miktarda bir düşüş (%53'ten %35'e) gözlenmektedir. Buna ek olarak, her iki kütle kaybı adımı da, belirli DTG pik sıcaklıklarındaki düşüşle (ilk DTG piki için 4 K'den 7 K'ye ve ikincisi için 11 K'den 15 K'ye) gösterildiği gibi, biraz daha düşük sıcaklıklara kaymıştır. Bu da helyum atmosferinde argon ve nitrojen atmosferlerinden farklı bir şeylerin olduğunu göstermektedir.
Literatürde, asetilsalisilik asidin PirolizPiroliz, organik bileşiklerin inert bir atmosferde termal olarak ayrışmasıdır.piroliz mekanizması olarak ara maddelerin eş zamanlı buharlaşmasını içeren iki aşamalı bir mekanizma önerilmektedir [7]. Azot ve helyum atmosferinde NETZSCH tarafından FT-IR [6] ve GC-MS [8] ile birlikte TGA/STA gibi tireli teknikler kullanılarak yapılan ölçümler bu hipotezi desteklemektedir. Bu da Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma ürünlerinin doğasının gaz atmosferinden bağımsız olduğunu göstermektedir.
Tüm bu deneyler arasındaki en büyük fark, kullanılan temizleme gazının yoğunluğudur (bkz. Tablo 2). Maksimum 10 kat farklılık göstermektedir.
Bu durum, daha yüksek yoğunluktaki temizleme gazının daha yüksek bir geri basınç oluşturduğunu ve bunun da uçucu numune bileşenlerinin gaz atmosferine daha az aktarılmasıyla sonuçlandığını göstermektedir. Bu etki özellikle azot veya argondan çok daha düşük bir yoğunluğa sahip olan helyum kullanıldığında görülür. Gerçek Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma reaksiyonları çevredeki inert gaz atmosferinden bağımsız olduğu için [10], belki de en çok etkilenen paralel buharlaşmadır.
Ayrışmanın helyumda biraz daha düşük sıcaklıklarda gerçekleşmesi (örneğin, azotta 187°C ve argonda yaklaşık 190°C'ye kıyasla 183°C'de DTG zirvesi), bu gazın daha yüksek termal iletkenliğinden kaynaklanmaktadır (bkz. Tablo 3). Termal radyasyonun sadece küçük bir rol oynadığı sıcaklık aralığında, numune daha yüksek termal iletkenliğe sahip bir boşaltma gazında reaksiyon sıcaklığına biraz daha erken ulaşır.
Tablo 2: Çeşitli temizleme gazlarının 0°C'deki ve normal basınçtaki YoğunlukKütle yoğunluğu, kütle ve hacim arasındaki oran olarak tanımlanır. yoğunluk değerleri
| Gaz | YoğunlukKütle yoğunluğu, kütle ve hacim arasındaki oran olarak tanımlanır. Yoğunluk / (g/cm³) [9] |
| Helyum | 0.178 |
| Azot | 1.251 |
| Argon | 1.784 |
Tablo 3: Çeşitli tasfiye gazlarının standart koşullar altında Termal İletkenlikTermal iletkenlik (W/(m-K) birimiyle λ), sıcaklık gradyanının bir sonucu olarak enerjinin - ısı şeklinde - kütleli bir cisim boyunca taşınmasını tanımlar (bkz. Şekil 1). Termodinamiğin ikinci yasasına göre, ısı her zaman düşük sıcaklık yönünde akar.termal iletkenlik değerleri
| Gaz | |
| Helyum | 0.1567 |
| Azot | 0.0260 |
| Argon | 0.0179 |
Sonuç
Mevcut örnek selectgaz atmosferinin boşaltma gazı bir reaksiyon ortağı olarak hareket etmese bile termogravimetrik ölçüm sonuçları üzerinde güçlü bir etkiye sahip olabileceğini göstermektedir. Büyük ölçüde değişen gaz yoğunluğu, gaz halindeki bileşiklerin numune yüzeyinden çevreleyen gaz atmosferine aktarılması üzerinde etkili olabilir - özellikle de BuharlaşmaBir elementin veya bileşiğin buharlaşması, sıvı fazdan buhara bir faz geçişidir. İki tür buharlaşma vardır: buharlaşma ve kaynama.buharlaşma söz konusuysa.