Einleitung
In der Pharmazie gibt es kaum einen Wirkstoff, über den mehr geschrieben wurde als über Acetylsalicylsäure (oder kurz ASS; im englischsprachigen Raum wird der Markenname Aspirin™ sogar oft als Synonym verwendet). Die Erfolgsgeschichte von Aspirin begann Ende des 19. Jahrhunderts, als Dr. Felix Hoffmann die Substanz in den BAYER-Laboren erstmals ohne Verunreinigungen synthetisierte. Bis heute ist es eines der beliebtesten Arzneimittel, das in einem breiten therapeutischen Spektrum eingesetzt wird. Es gehört zur Gruppe der nichtsteroidalen, entzündungshemmenden Antirheumatika (NSAIDs) und wird zur Behandlung von Schmerzen, Fieber und Entzündungen eingesetzt. Außerdem wird es zur Vorbeugung eines erneuten Herzinfarkts oder Schlaganfalls bei Risikopatienten angewandt. 1977 wurde ASS als Analgetikum in die “Liste der unentbehrlichen Arzneimittel“ der WHO (Weltgesundheitsorganisation) aufgenommen. [1]
Dies ist eines von vier Application Notes, die das thermische Verhalten von Acetylsalicylsäure näher untersuchen: Zersetzung in unterschiedlichen Gasatmosphären, Zersetzungskinetik und die entstehenden Gasspezies.
Tabelle 1: Messparameter
| Parameter | Acetylsalicylsäure |
| Probeneinwaage | Ca. 5 mg |
| Atmosphäre | Argon, Stickstoff und Helium |
| Tiegel | Al2O3, 85 μl, offen |
| Temperaturprogramm | RT bis 600 °C |
| Spülgasrate | 40 ml/min |
| Probenhalter | TG, Typ P |
Experimenteller Teil
Das Probenmaterial Acetylsalicylsäure (CAS: 50-78-2) mit einer Reinheit von >99 % wurde von Sigma Aldrich bezogen. Es handelt sich um ein weißes, kristallines Pulver, das in drei Kristallmodifikationen vorkommt [2]. Form I mit einem Schmelzpunkt von ca. 137 °C [4] ist die stabilste Form bei Raumtemperatur und darüber [3].
Aufgrund seiner Verfügbarkeit und des vergleichsweise geringen Preises werden Pyrolyseversuche meist in Stickstoffatmosphäre durchgeführt. Dies spiegelt sich auch in mehreren Veröffentlichungen, z.B. [5] and [6], wider. Zur Beantwortung der Frage, ob sich die unter Stickstoff erhaltenen Ergebnisse auch auf andere Atmosphären übertragen lassen, wurde eine Versuchsreihe durchgeführt, um das thermische Verhalten von Acetylsalicylsäure in Abhängigkeit von der Art des Spülgases zu untersuchen. Neben Stickstoff wurden Helium und Argon als Inertgasatmosphären verwendet. Die entsprechenen Messparameter sind in Tabelle 1 zusammengefasst.
Zur Charaketerisierung des thermischen Verhaltens wurde eine NETZSCH TG 209 F1 eingesetzt.
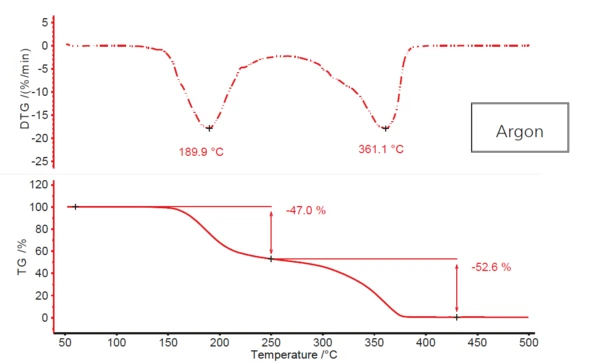
Abbildung 1 zeigt das charakteristische zweistufige Zersetzungsprofil von Acetylsalicylsäure als Ergebnis der Aufheizung der Substanz in dynamischer Argonatmosphäre. Die erste Stufe mit einer DTG-Peaktemperatur von ca. 190 °C beträgt 47 %; die zweite Stufe bei 361 °C (erneut DTG-Peaktemperatur) weist einen Massenverlust von nahezu 53 % auf. Zwischen den zwei Massenverluststufen tritt jedoch kein echtes Plateau auf. Die erste Massenverluststufe geht mehr oder weniger in die zweite über. Dies deutet darauf hin, dass möglicherweise mehr als zwei Massenänderungsprozesse beteiligt sind. Die Möglichkeit eines solchen komplexen Mechanismus‘ wird zusätzlich durch die Tatsache gestützt, dass der zweite DTG-Peak eine deutlich sichbare Schulter in der abfallenden Flanke bei ca 320 °C aufweist.
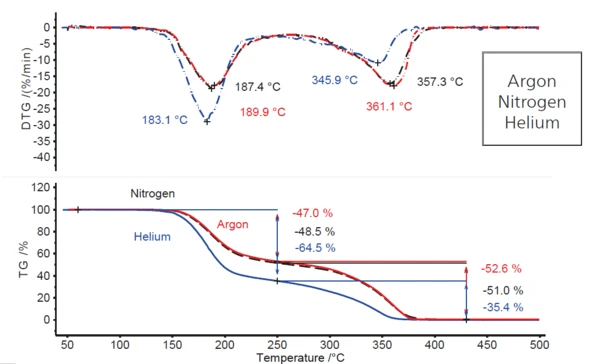
Vergleicht man die Situation in Argonatmosphäre mit Untersuchungen, die bei identischen Heizraten sowohl in Stickstoff- als auch in Heliumatmosphäre (Abbildung 2) durchgeführt wurden, zeigt sich, dass das Verhalten unter Stickstoffbedingungen in etwa dem in Argon entspricht, während es sich unter einer dynamischen Heliumatmosphäre deutlich verändert. Es ist ein Anstieg der ersten Massenverluststufe um ca. 18 Prozentpunkte (von 47 % auf fast 65%) und folglich ein Rückgang der zweiten Massenverluststufe um den gleichen Betrag (von 53 % auf 35%) zu beobachten. Darüberhinaus sind beide Massenverluststufen zu etwas niedrigeren Temperaturen verschoben, was durch die Abnahme der jeweiligen DTG-Peaktemperaturen aufgezeigt wird (4 K bis 7 K für den ersten DTG-Peak und 11 K bis 15 K für den zweiten). Dies ist ein Hinweis, dass die Zersetzung in Heliumatsmophäre von der in Argon- und Stickstoffatmosphäre abweicht.
In der Literatur wird ein zweistufiger Mechanismus mit gleichzeitiger VerdampfungVerdampfung beschreibt die Phasenumwandlung eines Stoffes von der flüssigen in die gasförmige Phase. Beim Verdampfen eines Stoffes unterscheidet man grundsätzlich zwei Formen, Sieden und Verdunstung.Verdampfung von Zwischenprodukten als Pyrolysemechanismus von Acetylsalicylisäure vorgeschlagen [7]. Eigene Messungen sowohl in Stickstoff- als auch Heliumatmosphäre unter Verwendung von Kopplungstechniken, genauer gesagt TG/STA in Kombination mit FT-IR [6] und GC-MS [8], unterstützen diese Hypothese. Dies deutet darauf hin, dass die Art der Zersetzungsprodukte unabhängig von der Gasatmosphäre ist.
Der Hauptunterschied zwischen all diesen Experimenten ist die DichteDie Massen-Dichte ist definiert als Verhältnis zwischen Masse und Volumen.Dichte des verwendeten Spülgases (siehe Tabelle 2). Sie unterschiedet sich maximal um den Faktor 10.
Dies deutet darauf hin, dass eine höhere DichteDie Massen-Dichte ist definiert als Verhältnis zwischen Masse und Volumen.Dichte des Spülgases einen höheren Gegendruck erzeugt, was zu einem reduzierten Übertritt der flüchtigen Probenbestandteile in die Gasatmosphäre führt. Dieser Effekt ist besonders sichtbar bei Verwendung von Helium, das im Vergleich zu Stickstoff und Argon eine wesentlich geringere Dichte aufweist. Da echte Zersetzungsreaktionen unabhängig von der umgebenden Inertgasatmosphäre sind [10], ist es vermutlich die gleichzeitig stattfindende VerdampfungVerdampfung beschreibt die Phasenumwandlung eines Stoffes von der flüssigen in die gasförmige Phase. Beim Verdampfen eines Stoffes unterscheidet man grundsätzlich zwei Formen, Sieden und Verdunstung.Verdampfung, die am meisten betroffen ist.
Die Tatsache, dass die Zersetzung in Helium bei geringfügig niedrigeren Temperature (z.B. DTG-Peak bei 183 °C im Vergleich zu 187 °C in Stickstoff und ca. 190 °C in Argon) stattfindet, ist auf die höhere WärmeleitfähigkeitDie Wärmeleitfähigkeit (λ mit der Einheit W/(m•K)) beschreibt den Transport von Energie - in Form von Wärme - durch einen Körper aufgrund eines Temperaturgefälles.Wärmeleitfähigkeit dieses Gases zurückzuführen (siehe Tabelle 3). In dem Temperaturbereich, in dem die Wärmestrahlung nur eine geringe Rolle spielt, erreicht die Probe die Reaktionstemperatur und ReaktionsenthalpieReaktionstemperatur und Reaktionsenthalpie können mit z.B. mit Hilfe der dynamischen Differenz Thermoanalyse (DSC) bestimmt werden. Das Verfahren dazu ist z.B. in der DIN EN ISO 11357-5 beschrieben.Reaktionstemperatur in einem Spügas mit höherer WärmeleitfähigkeitDie Wärmeleitfähigkeit (λ mit der Einheit W/(m•K)) beschreibt den Transport von Energie - in Form von Wärme - durch einen Körper aufgrund eines Temperaturgefälles.Wärmeleitfähigkeit etwas früher.
Tabelle 2: Dichtewerte bei 0 °C und Normaldruck der unterschiedlichen Spülgase
| Gas | Dichte / (g/cm³) [9] |
| Helium | 0,178 |
| Stickstoff | 1,251 |
| Argon | 1,784 |
Tabelle 3: Wärmeleitfähigkeitswerte unter Normbedingunen der unterschiedlichen Spülgase
| Gas | Wärmeleitfähigkeit (W/m·K) [11] |
| Helium | 0,1567 |
| Stickstoff | 0,0260 |
| Argon | 0,0179 |
Zusammenfassung
Das vorliegende Beispiel zeigt, dass die gewählte Gasatmosphäre großen Einfluss auf die thermogravimetrischen Messergebnisse haben kann, auch wenn das Spülgas nicht als Reaktionspartner fungiert. Eine stark unterschiedliche Gasdichte kann sich auf den Transfer gasförmiger Verbindungen von der Probenoberfläche in die umgebende Gasatmosphäre auswirken – insbesondere dann, wenn Verdampfung ins Spiel kommt.