Введение
В фармацевтике вряд ли найдется активный ингредиент, о котором написано больше, чем об ацетилсалициловой кислоте (сокращенно АСА; в англоязычных странах в качестве синонима часто используется даже торговое название Aspirin™). История ее успеха началась в конце XIX века, когда доктор Феликс Хоффманн впервые синтезировал это вещество в лабораториях BAYER без примесей. Сегодня это один из самых популярных фармацевтических препаратов, используемых в широком терапевтическом диапазоне. Он относится к группе нестероидных противовоспалительных препаратов (НПВП) и показан для лечения боли, лихорадки и воспаления. Кроме того, он используется для профилактики повторного инфаркта или инсульта у пациентов с высоким риском. В 1977 году АСА был добавлен в качестве анальгетика в "список основных лекарственных средств" ВОЗ (Всемирной организации здравоохранения). [1]
Это одна из четырех заметок, в которых более подробно рассматривается термическое поведение ацетилсалициловой кислоты: разложение в различных газовых средах, кинетика разложения и образующиеся газовые виды.
Таблица 1: Параметры измерения
| Параметр | Ацетилсалициловая кислота |
| Масса образца | Приблизительно 5 мг |
| Атмосфера | Аргон, азот и гелий |
| Крюсиль | Al2O3, 85 мкл, открытый |
| Температурная программа | От RT до 600°C |
| Скорость потока | 40 мл/мин |
| Держатель образца | TGA, тип P |
Экспериментальный
Образец ацетилсалициловой кислоты (CAS: 50-78-2) был приобретен у компании Sigma Aldrich с чистотой > 99%. Это белый кристаллический порошок, который существует в трех кристаллических модификациях [2]. Форма I, с температурой плавления около 137°C [4], является наиболее стабильной при температуре окружающей среды и выше [3].
Эксперименты по пиролизу обычно проводятся в атмосфере азота из-за его доступности и сравнительно низкой цены. Это также отражено в ряде публикаций, например [5] и [6]. Чтобы ответить на вопрос, можно ли обобщить результаты, полученные в азоте, на другие атмосферы, была проведена серия экспериментов по изучению термического поведения ацетилсалициловой кислоты в зависимости от природы продувочного газа. Кроме азота, в качестве инертного газа использовались гелий и аргон. Соответствующие параметры измерений приведены в таблице 1.
Для определения характеристик термического поведения использовался прибор NETZSCH TG 209 F1 .
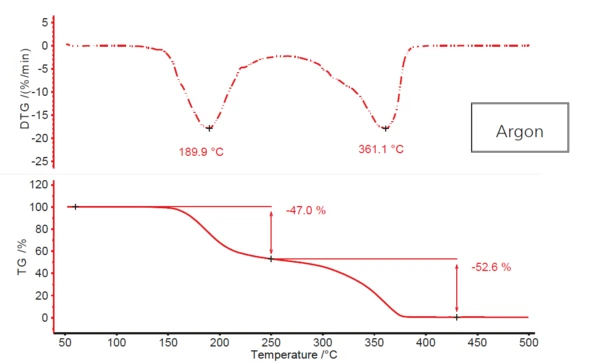
На рис. 1 представлен типичный двухступенчатый профиль разложения ацетилсалициловой кислоты, полученный при нагревании вещества в атмосфере проточного аргона. На первом этапе, с температурой пика ДТГ около 190°C, потеря массы составляет 47%; на втором этапе, при 361°C (снова температура пика ДТГ), - почти 53%. Однако между двумя ступенями потери массы не возникает настоящего плато. Первая ступень более или менее сливается со второй. Это указывает на то, что, возможно, в процессе участвуют более двух стадий разложения. В пользу того, что в данном случае имеет место более сложный механизм, говорит и тот факт, что второй пик ДТГ имеет четко выраженное плечо при температуре около 320°C на нисходящем склоне.
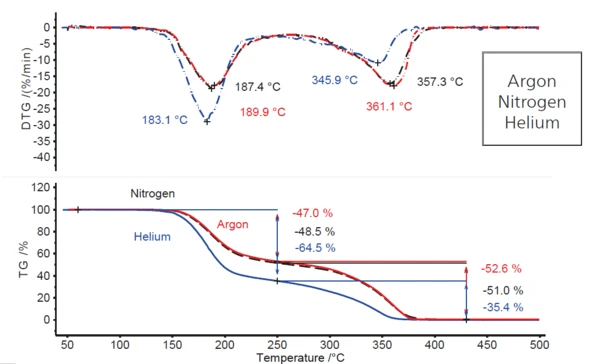
Сравнение ситуации в атмосфере аргона с экспериментами, проведенными при одинаковых скоростях нагрева в атмосферах азота и гелия (рис. 2), показывает, что поведение в условиях азота примерно такое же, как и в аргоне, тогда как в проточной атмосфере гелия оно существенно меняется. Наблюдается увеличение первого шага потери массы примерно на 18 процентных пунктов (с 47 % до почти 65 %) и, соответственно, уменьшение второго шага потери массы на такую же величину (с 53 % до 35 %). Кроме того, обе стадии потери массы смещаются на несколько более низкие температуры, о чем свидетельствует снижение конкретных температур пиков ДТГ (с 4 К до 7 К для первого пика ДТГ и с 11 К до 15 К для второго). Это говорит о том, что в атмосфере гелия происходит нечто иное, чем в атмосферах аргона и азота.
В литературе в качестве механизма пиролиза ацетилсалициловой кислоты предложен двухступенчатый механизм с одновременным испарением промежуточных продуктов [7]. Измерения, проведенные на сайте NETZSCH как в атмосфере азота, так и в атмосфере гелия с использованием дефисных методов, а точнее, ТГА/СТА в сочетании с ИК-Фурье [6] и ГХ-МС [8], подтверждают эту гипотезу. Это указывает на то, что природа продуктов разложения не зависит от газовой атмосферы.
Основное различие между всеми этими экспериментами заключается в плотности используемого продувочного газа (см. табл. 2). Она отличается максимально в 10 раз.
Это говорит о том, что более высокая плотность продувочного газа создает более высокое противодавление, что приводит к уменьшению перехода летучих компонентов образца в газовую атмосферу. Этот эффект особенно заметен при использовании гелия, который имеет гораздо меньшую плотность, чем азот или аргон. Поскольку истинные реакции разложения не зависят от окружающей атмосферы инертного газа [10], то, возможно, именно параллельное испарение оказывает наибольшее влияние.
Тот факт, что разложение происходит при несколько более низких температурах в гелии (например, пик ДТГ при 183°C по сравнению с 187°C в азоте и примерно 190°C в аргоне), объясняется более высокой теплопроводностью этого газа (см. таблицу 3). В диапазоне температур, где тепловое излучение играет лишь незначительную роль, образец достигает температуры реакции в продувочном газе с более высокой теплопроводностью несколько раньше.
Таблица 2: Значения плотности при 0°C и нормальном давлении различных продувочных газов
| Газ | Плотность / (г/см³) [9] |
| Гелий | 0.178 |
| Азот | 1.251 |
| Аргон | 1.784 |
Таблица 3: Значения теплопроводности различных продувочных газов при стандартных условиях
| Газ | Теплопроводность (Вт/м-К) [11] |
| Гелий | 0.1567 |
| Азот | 0.0260 |
| Аргон | 0.0179 |
Заключение
selectНастоящий пример показывает, что газовая атмосфера может оказывать сильное влияние на результаты термогравиметрических измерений, даже если продувочный газ не выступает в качестве партнера по реакции. Сильно изменяющаяся плотность газа может влиять на перенос газообразных соединений с поверхности образца в окружающую газовую атмосферу - особенно если происходит испарение.