Introdução
O tratamento térmico de diferentes materiais pode levar à liberação de amônia, que tem um odor agressivo e pode atacar o sistema brônquico. A liberação de amônia pode ser causada por uma variedade de processos diferentes. Eles vão desde a Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição térmica de sais até a fumaça da queima do tabaco, passando pela PiróliseA pirólise é a decomposição térmica de compostos orgânicos em uma atmosfera inerte.pirólise de polímeros, como as poliamidas (PA), e pela fabricação de espumas plásticas que requerem agentes de expansão. Um produto comumente conhecido dessa última categoria são os tapetes de ioga. A liberação de amônia pode criar poeira fina ao reagir com ácido sulfúrico e ácido nítrico quando os sais são formados. No meio ambiente, a liberação de amônia pode levar à acidificação do solo. Uma das principais fontes de amônia no meio ambiente é a agricultura, especialmente a fertilização com fertilizantes minerais contendo esterco e nitrogênio.
Por esse motivo, a quantificação da amônia liberada tem sido importante em muitas aplicações. A liberação de amônia dependente da temperatura pode ser facilmente detectada por meio do acoplamento TGA-FT-IR. Para quantificar a porção de amônia liberada, é necessário ter uma curva de calibração com uma concentração conhecida de amônia. Um composto adequado para isso é o bicarbonato de amônio, pois ele libera amônia em uma proporção estequiométrica, além da liberação de água e dióxido de carbono; veja a equação (1). Somente compostos gasosos são produzidos:
(1) NH4HCO3->NH3 + H2O+ CO2
Como gerar a curva de conversãolibra
Um NETZSCH PERSEUS® TG 209 F1 Libra® foi usado para realizar este estudo. O aquecimento do bicarbonato de amônio resultou na Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição completa a 200 °C, com um pico na taxa de perda de massa a 127 °C (com base nas condições de medição da tabela 1).
Tabela 1: Condições de medição para a geração da curva de calibração
| Parâmetro | NH4HCO3 | |||
| Programa de temperatura | RT - 200°C, 5 K/min | |||
| Taxa de fluxo | 40 ml/min | |||
| Suporte de amostra | Transportador de amostra padrão | |||
| Atmosfera de gás | Nitrogênio | |||
| Cadinho | Al2O3 (85 μl) aberto | |||
| Massa da amostra | 5.31 mg | 10.16 mg | 15.01 mg | 20.50 mg |
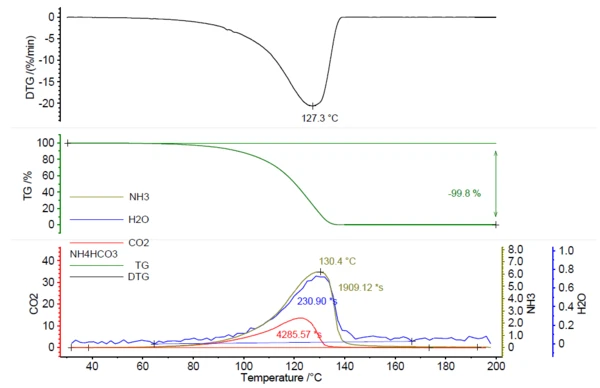
Em correlação com a perda de massa, foi detectada a liberação de gases ativos de IR; veja a figura 1.
A Figura 2 mostra o espectro FT-IR medido a 130°C (verde) em correlação com os espectros library de amônia (verde-oliva), água (azul) e dióxido de carbono (vermelho). A liberação dependente da temperatura desses compostos foi plotada como traços na Figura 1. Esses traços foram criados pela integração das regiões coloridas (veja a figura 2) dos espectros FT-IR de cada composto em toda a faixa de temperatura. Essas regiões dos espectros de FT-IR foram separadas para NH3 (898 cm-1 - 981 cm-1),CO2 (2200 cm-1 - 2450 cm-1) e H2O(3793 cm-1 - 4001 cm-1) e não houve sobreposição com regiões de outros compostos.
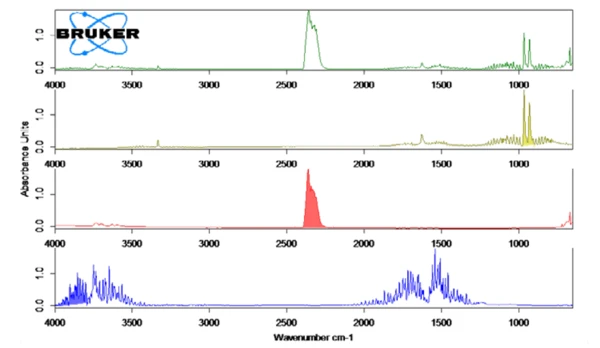
A Tabela 2 mostra as quantidades estequiometricamente calculadas dos gases liberados em relação à massa da amostra de bicarbonato de amônio.
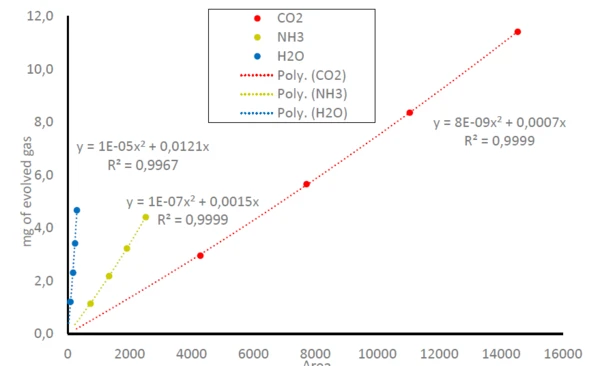
Consequentemente, as áreas abaixo dos traços de NH3,CO2 e H2Ona figura 1 podem ser relacionadas à quantidade de gases liberados; compare a equação (1).libraIsso leva a curvas de detecção para NH3,CO2 e H2Oem que a área detectada abaixo dos traços está relacionada à quantidade de gás liberado; veja a figura 3. Como o FT-IR tem apenas uma faixa linear de small, isso resulta em equações polinomiais para todas as três moléculas gasosas com coeficientes de determinação (R2) muito próximos de 1. Neste estudo, cada massa de amostra foi medida apenas uma vez. Medições repetidas ou mais pontos de dados levariam a uma precisão ainda maior na linha de tendência.
Tabela 2: Massa da amostra e quantidades estequiométricas resultantes do gás evoluído
| m (NH4HCO3) [mg] | m (CO2) [mg] | m (NH3) [mg] | m (H2O) [mg] |
| 5.31 | 2.96 | 1.14 | 1.21 |
| 10.16 | 5.66 | 2.19 | 2.31 |
| 15.01 | 8.36 | 3.23 | 3.42 |
| 20.50 | 11.42 | 4.41 | 4.67 |
Como testar a precisão da curva de calibração do Calibra
A precisão da curva de íons calibrafoi verificada com outra medição em NH4HCO3 com uma massa de amostra definida de 15,22 mg. As quantidades teóricas de NH3,CO2 e H2Oforam comparadas com os valores calculados de NH3,CO2 e H2Ousando a curva de calibração. Isso gerou valores de erro entre 0,8% para NH3 e 4,9% para H2O; consulte a tabela 3.
Estudo de um agente de sopro - Colocando a teoria em prática
Na próxima etapa, as curvas de calibração obtidas e verificadas poderiam ser usadas para quantificar a liberação de quantidades desconhecidas dos gases calibratados.
A azodicarbonamida é usada como agente de expansão para produzir espumas de polímero (para ver a estrutura, consulte a Figura 4). Ela é empregada na fabricação de espumas de PVC e espumas de EVA-PE, onde forma bolhas após a Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição em temperaturas de processamento, pois libera N2, CO,CO2 e NH3. A espuma de vinil é facilmente comprimida e apresenta recuperação alta e rápida, por isso é frequentemente chamada de "elástica". Ela também adere a superfícies lisas. Por esse motivo, é usada para revestimento de carpetes, tapetes de chão e tapetes de ioga.
Os polímeros para os quais esse agente de expansão foi usado não podem entrar em contato com a água. O NH3 e a água podem formar NH4OHe corroer os arredores. Por esse motivo, a quantificação da amônia desse agente de expansão é de grande interesse.
Tabela 3: Determinação de erros, comparação de valores teóricos e calculados
Teórica (mg) | Calculado (mg) | Erro (%) | |
| m (NH4HCO3) | 15.22 | ||
| m (NH3) | 3.28 | 3.30 | 0.801 |
| m (CO2) | 8.48 | 8.76 | 3.28 |
| m (H2O) | 3.47 | 3.31 | 4.86 |
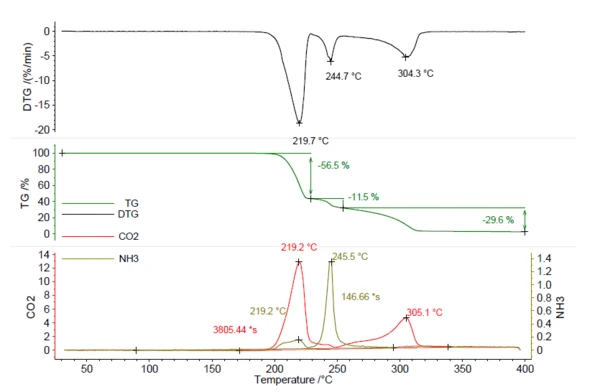
Uma amostra de 5,25 mg de azodicarbonamida foi aquecida a 400°C a 5 K/min em uma atmosfera de nitrogênio. O termograma resultante pode ser visto na Figura 5. No total, três etapas de perda de massa de 56,5%, 11,5% e 29,6% foram observadas com picos na curva DTG a 219°C, 245°C e 304°C. Os traços deCO2 e NH3 foram criados da mesma forma que para o NH4HCO3 na figura 1 e estão representados em vermelho e oliva. Isso mostra que tantoo CO2 quanto o NH3 foram liberados durante as várias etapas de perda de massa e não podem ser quantificados apenas pelas etapas de TGA. Para quantificar esse composto, são necessários dados da análise de gás evoluído. O cálculo da amônia liberada usando a curva de calibração resultou em 0,22 mg de NH3 (4%). Além disso, a quantidade deCO2 liberada pode ser calculada da mesma forma e resultou em 2,78 mg (53%). Esse conhecimento é valioso para o processo de fabricação, a fim de garantir que toda a quantidade do agente de expansão seja liberada durante a formação de espuma. Se restarem vestígios de small no produto, serão necessárias temperaturas superiores a 219°C para iniciar a liberação.
Conclusão
A combinação de termogravimetria e espectroscopia de infravermelho é um método adequado para detectar a liberação de gases permanentes, por exemplo, água, dióxido de carbono e amônia. Não é apenas a identificação, mas também a quantificação que pode ser de interesse aqui. Para isso, é necessário gerar uma curva de calibração com um material conhecido. Neste exemplo, o bicarbonato de amônio atende perfeitamente a esses requisitos.libraAs curvas de íons de cálcio podem ser criadas simultaneamente para H2O,CO2 e NH3 por meio da Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição de três porções diferentes de NH4HCO3. Os desvios a serem detectados foram determinados por uma quinta medição. Com essa preparação, foi possível identificar e quantificar quantidades desconhecidas de NH3 eCO2 do agente de expansão azodicarbonamida usado para espumas de polímero.