Введение
Уже в ранних высоких культурах ивовая кора использовалась как средство от лихорадки и боли [1]; римский ученый Плиний Старший считал ивовую кору лекарством, а тевтоны и кельты путем варки ивовой коры получали экстракты, ингредиенты которых были химически связаны с синтетической ацетилсалициловой кислотой [2]. Хотя в XIX веке различные химики смогли получить салицин и салициловую кислоту, только в 1897 году Феликсу Хоффманну удалось синтезировать ацетилсалициловую кислоту без примесей в штаб-квартире компании BAYER в Вупперталь-Эльберфельде, Германия. В последующие годы Курт Виттауэр (рис. 2) испытывал это лекарство на пациентах, пока в 1921 году компания BAYER (рис. 1) наконец не подала заявку на соответствующий патент. Обезболивающее начало пользоваться триумфальным успехом во всем мире, и сегодня компания BAYER производит более 50 000 тонн ацетилсалициловой кислоты в год [4].


Препараты, содержащие активное вещество ацетилсалициловую кислоту, выпускаются в различных лекарственных формах и применяются не только благодаря своему обезболивающему эффекту, но и благодаря противовоспалительным, жаропонижающим и противотромбоцитарным свойствам.
Чистая ацетилсалициловая кислота представляет собой чистый белый порошок, плохо растворимый в воде, с температурой плавления 136°C и разлагающийся при более высоких температурах. Для исследования газообразных продуктов разложения в данной работе использовались различные методы термического анализа, инфракрасной спектроскопии и их комбинации.
Методы и подготовка
Ацетилсалициловая кислота (CAS: 50-78-2) была приобретена у компании Sigma Aldrich с чистотой > 99%. Для исследования исходного вещества использовался прибор BRUKER TENSOR II для измерения образцов с ослабленным полным отражением (ATR). Для определения плавления использовался прибор NETZSCH DSC 214 Polyma. Для термической характеризации выделяющихся газов термобаланс был соединен с инфракрасным спектрометром - NETZSCH TG 209 F1 Libra® с Bruker Equinox 55/S. Условия измерений для термоаналитических и спектроскопических исследований сведены в таблицы 1 - 3.
Таблица 1: Условия измерения для ДСК-исследования ацетилсалициловой кислоты
| Ацетилсалициловая кислота | |
|---|---|
| Масса образца | 2.08 мг |
| Материал тигля | Алюминий, колотый |
| Масса тигля | 52.75 мг |
| Диапазон температур | 25 ... 160°C |
| Скорость нагрева | 7 К/мин |
| Атмосфера | Азот (50 мл) |
Таблица 2: Условия измерения для термогравиметрического исследования таблетки Аспирина® с помощью ТГА-ФТ-ИК
| Аспирин® | |
|---|---|
| Масса образца | 9.141 мг |
| Материал тигля | Глинозем, открытый |
| Масса тигля | 162.75 мг |
| Диапазон температур | 25 ... 600°C |
| Скорость нагрева | 10 К/мин |
| Атмосфера | Азот (40 мл) |
| Сканирование | 32 |
| Разрешение | 4 см-1 |
| Спектральный диапазон | 650 - 4500 см-1 |
Таблица 3: Условия измерения для спектроскопического исследования (ATR) ацетилсалициловой кислоты
| Ацетилсалициловая кислота | |
|---|---|
| Детектор | DTGS |
| Сканирование | 32 |
| Разрешение | 4 см-1 |
| Спектральный диапазон | 650 - 4500 см-1 |
Результаты и обсуждение
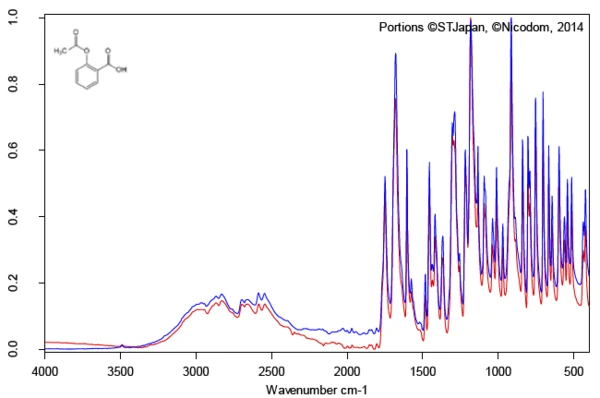
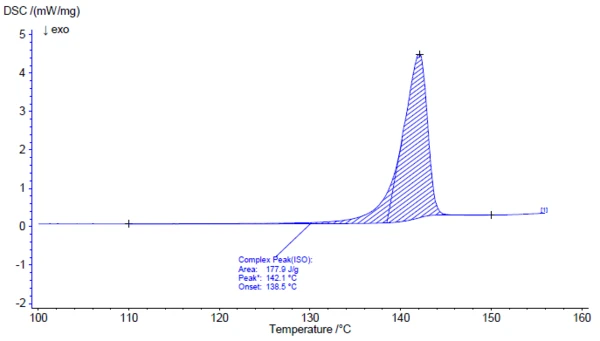
Исследование активного ингредиента ацетилсалициловой кислоты с помощью ИК-Фурье спектроскопии позволило получить инфракрасный спектр при комнатной температуре, который хорошо согласуется со спектром library (Bruker ATR-LIBPolymers-1-472-2) (рисунок 3). Диапазон плавления ацетилсалициловой кислоты, по данным производителя, составляет 134-136°C. Исследование с помощью дифференциальной сканирующей калориметрии (ДСК) дает энтальпию плавления 178 Дж/г и температуру экстраполированного начала плавления 138,5°C. Как также хорошо видно из рисунка 4, сигнал теплового потока указывает на начало процесса плавления образца уже при значительно более низких температурах, чем те, которые были определены в результате стандартной оценки экстраполированного начала. В литературе описаны две полиморфные формы ацетилсалициловой кислоты: Форма I с температурой плавления 144,9°C и Форма II с температурой плавления 135,5°C [5, 6].
При температуре выше 150°C начинается термическая деструкция ацетилсалициловой кислоты. Поэтому термогравиметрия (ТГА) лучше подходит для дальнейшей характеристики выше точки плавления (рис. 5).
Для характеристики термической деградации кусочек таблетки аспирина был исследован с помощью ТГА-ФТ-ИК-связи. Хотя результаты термогравиметрии при температурах от 150 до 450 °C свидетельствуют о двухступенчатой реакции термической деструкции и количество выделяющихся газов может быть определено количественно, без спектроскопического анализа невозможно определить, какие газы ответственны за обнаруженную потерю массы. Если провести измерения, соединив термовесы с инфракрасным спектрометром, то газовую фазу можно исследовать непрерывно в течение всего измерения. Все инфракрасные спектры представлены на рисунке 6 в трехмерном виде с температурным масштабом. Результаты термогравиметрических измерений также можно увидеть в левой задней области.
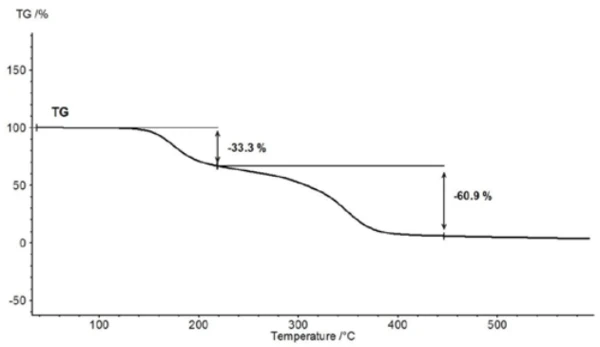
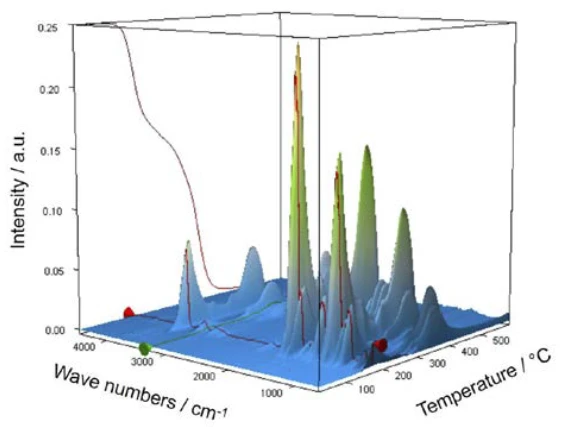
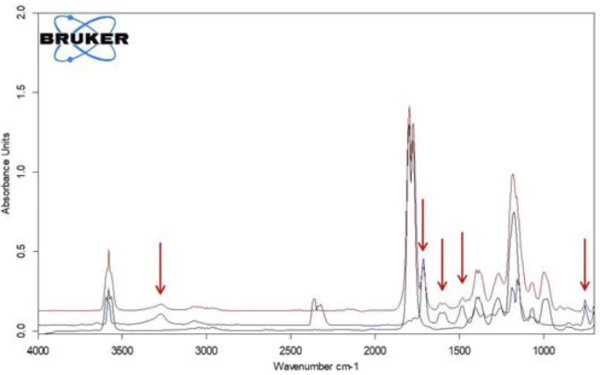
Если из этого представления извлечь индивидуальные спектры при температурах с наибольшей интенсивностью поглощения, то выделившиеся газы можно идентифицировать с помощью спектров сравнения из газовой фазы libraри. Характерный индивидуальный спектр для первой ступени потери массы при 180°C очень хорошо согласуется со спектром уксусной кислоты из газовой фазы EPANIST library (рис. 7). Красными стрелками отмечены полосы поглощения, которые не соответствуют уксусной кислоте, но очень хорошо согласуются с полосами поглощения салициловой кислоты (EPA-NIST). Это позволяет предположить, что ацетилсалициловая кислота, как в уравнении реакции 1, термически разлагается на салициловую и уксусную кислоты (уравнение 1). При температуре 180°C образовавшаяся уксусная кислота уже находится в газообразном состоянии, в то время как салициловая кислота, имеющая температуру плавления 159°C, начинает испаряться. Это, безусловно, также является причиной того, что первый этап потери массы переходит непосредственно в следующий этап. Сочетание разложения и испарения подтверждает механизм деградации, предложенный Ребейро и другими [7]. В связи с таблетированной формой активного ингредиента ацетилсалициловой кислоты подчеркивается влияние влажности на продукты реакции термической деструкции, а также добавок, таких как starch и моногидрат стеарата магния. Гупчуп и др., однако, указывают, что сухой активный ингредиент ацетилсалициловая кислота сама может обеспечить присутствие воды за счет димеризации в смысле конденсации [8].
При сравнении двух спектров для уксусной и салициловой кислот заметно, что полосы поглощения в диапазоне между 1760 см-1 и 1820 см-1 можно отнести только к уксусной кислоте, в то время как полосы поглощения между 1460 см-1 и 1500 см-1 представляют салициловую кислоту. Если рассчитать ход интенсивности полос поглощения в зависимости от температуры, то для каждого вещества получаются "следы", которые пропорциональны соответствующим количествам, выделяющимся в зависимости от температуры.
(Уравнение 1)
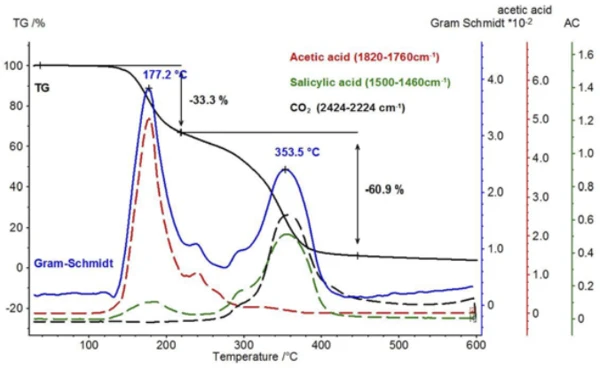
Сравнение этих температурно-зависимых следов для уксусной и салициловой кислот показано на рисунке 8 со следом Грама-Шмидта (сумма интенсивностей, не зависящих от длины волны) и сигналом ТГА. Как и в случае с сигналом ТГА, след Грамма-Шмидта показывает, что первая ступень потери массы переходит непосредственно и без плато во вторую ступень потери массы. Причину этого можно найти в следах двух продуктов, которые показывают, что выделение уксусной кислоты можно обнаружить примерно до 300°C, и, кроме того, испарение салициловой кислоты начинается уже при более низких температурах.
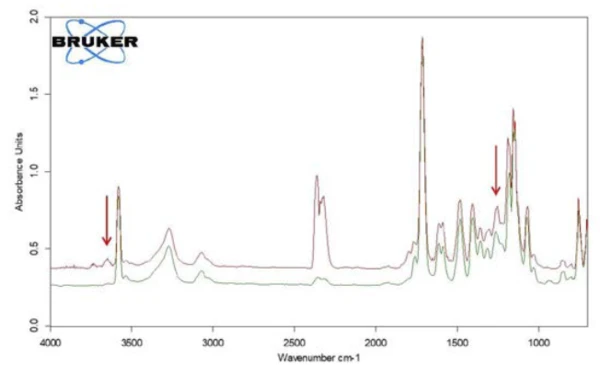
Наряду с салициловой кислотой, образование углекислого газа можно обнаружить по зависящему от температуры ходу интенсивности поглощения. Это подтверждается полученным индивидуальным спектром при 360°C (рис. 9).
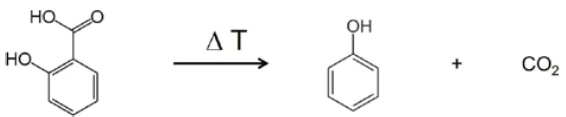
В диапазоне между волновыми числами 2424 и 2224 отчетливо видны полосы поглощенияCO2. Кроме того, есть признаки образования фенола. Положения наиболее интенсивных полос поглощения фенола отмечены красными стрелками. Поэтому можно предположить, что наряду с испарением салициловой кислоты происходит и процесс ее разложения; это предполагает образование фенола иCO2, как показано в уравнении 2.
(Уравнение 2)
Резюме
Ацетилсалициловую кислоту исследовали методом ИК-Фурье спектроскопии при комнатной температуре (АТР), а полученные ИК-Фурье спектры использовали для идентификации путем сравнения со спектром library. ДСК использовалась для исследования поведения при плавлении. Кроме того, термическое поведение Аспирина® было охарактеризовано с помощью ТГА-ФТ-ИК. Спектры газов, выделяющихся при термической обработке, сравнивались с газовой фазой library для идентификации продуктов. Таким образом, удалось подтвердить механизмы деградации, известные из литературы, и дополнительно показать, что обычные добавки, используемые при таблетировании Аспирина®, не оказывают заметного влияния на образование газообразных продуктов разложения.