Einleitung
Frühe Hochkulturen setzten bereits Weidenrinde als Mittel gegen Fieber und Schmerzen ein [1], der römische Gelehrte Plinius der Ältere sah Weidenrinde als Arznei an und die Germanen und Kelten gewannen durch Kochen von Weidenrinde Extrakte, deren Inhaltsstoffe chemisch verwandt zur synthetischen Acetylsalicylsäure waren [2]. Zwar konnten verschiedene Chemiker im 19. Jahrhundert Salicin und Salicylsäure herstellen, doch erst 1897 gelang es Felix Hoffmann im BAYER-Stammwerk in Wuppertal-Elberfeld, Acetylsalicylsäure ohne Verunreinigungen zu synthetisieren. Kurt Wittauer (Abbildung 2) testete dieses Präparat in den Folgejahren an Patienten, bis die Firma BAYER (Abbildung 1) schließlich 1921 das dazugehörige Patent anmeldete. Das Schmerzmittel trat einen Siegeszug um die ganze Welt an und so produziert die Firma BAYER heute mehr als 50000 Tonnen Acetylsalicylsäure pro Jahr [4].


Medikamente mit dem Wirkstoff Acetylsalicylsäure sind in verschiedenen Darreichungsformen erhältlich und werden nicht nur wegen ihrer schmerzstillenden, sondern auch wegen ihrer entzündungshemmenden, fiebersenkenden und thrombozytenaggregationshemmenden Wirkung eingesetzt.
Reine Acetylsalicylsäure ist ein reinweißes Pulver, das schlecht in Wasser löslich ist, einen Schmelzpunkt von 136 °C aufweist und sich bei höherer Temperatur zersetzt. Zur Untersuchung der gasförmigen Zersetzungsprodukte wurden in dieser Arbeit verschiedene Methoden der Thermischen Analyse, der Infrarotspektroskopie sowie deren Kombinationen verwendet.
Methoden und Präparation
Acetylsalicylsäure (CAS: 50-78-2) wurde von der Firma Sigma Aldrich in einer Reinheit von > 99 % erworben. Für die Untersuchung der Ausgangssubstanz mittels FT-IR kam der BRUKER TENSOR II zum Einsatz, in dem die Proben mittels ATR-Infratrotspektroskopie (engl. Attenuated Total Reflection, abgeschwächte Totalreflexion) gemessen wurden. Mit der NETZSCH DSC 214 Polyma konnte das Schmelzverhalten untersucht werden und für die thermische Charakterisierung hinsichtlich der freigesetzten Gase wurde die Kopplung einer Thermowaage mit einem Infrarotspektrometer, die NETZSCH TG 209 F1 Libra® zusammen mit dem Bruker Equinox 55/S verwendet.
Die Messbedingungen für die thermoanalytischen und die spektroskopischen Untersuchungen sind in den Tabellen 1 bis 3 zusammengefasst.
Tabelle 1: Messbedingungen für die DSC-Untersuchung von Acetylsalicylsäure
| Acetylsalicylsäure | |
|---|---|
| Probenmasse | 2,08 mg |
| Tiegelmaterial | Aluminium, gelocht |
| Tiegelmasse | 52,75 mg |
| Temperaturbereich | 25 ... 160 °C |
| Aufheizrate | 7 K/min |
| Atmosphäre | Stickstoff (50 ml) |
Tabelle 2: Messbedingungen für die thermogravimetrische Untersuchung einer Aspirin®-Tablette mittels TG-FT-IR
| Aspirin® | |
|---|---|
| Probenmasse | 9,141 mg |
| Tiegelmaterial | Aluminiumoxid, offen |
| Tiegelmasse | 162,75 mg |
| Temperaturbereich | 25 ... 600 °C |
| Aufheizrate | 10 K/min |
| Atmosphäre | Stickstoff (40 ml) |
| Scans | 32 |
| Auflösung | 4 cm-1 |
| Spektralbereich | 650 - 4500 cm-1 |
Tabelle 3: Messbedingungen für die spektroskopische Untersuchung (ATR) von Acetylsalicylsäure
| Acetylsalicylsäure | |
|---|---|
| Detektor | DTGS |
| Scans | 32 |
| Auflösung | 4 cm-1 |
| Spektralbereich | 650 - 4500 cm-1 |
Ergebnisse und Diskussion
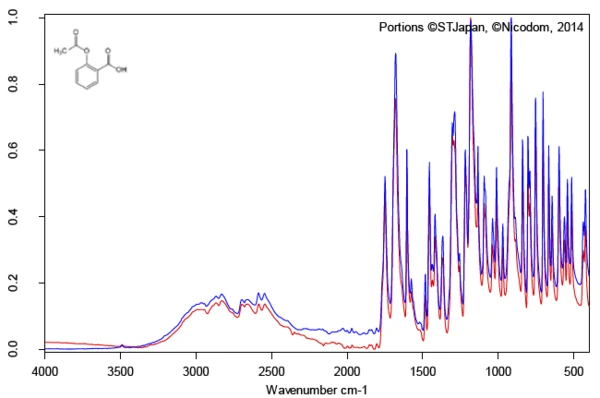
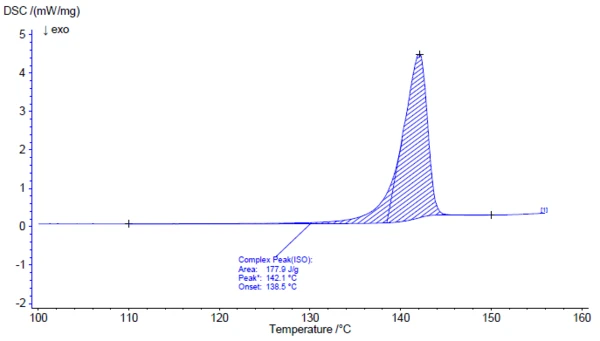
Die Untersuchung des Wirkstoffs Acetylsalicylsäure mit Hilfe der FT-IR Spektroskopie liefert bei Raumtemperatur ein Infrarotspektrum, welches in sehr guter Weise mit dem Bibliotheksspektrum (Bruker ATR-LIBPolymers-1-472-2) übereinstimmt (Abbildung 3). Der Schmelzbereich von Acetylsalicylsäure wird vom Hersteller mit 134 °C bis 136 °C angegeben. Die Untersuchung mittels dynamischer Differenz-Kalorimetrie (DSC, engl. Differential Scanning Calorimetry) liefert eine Schmelztemperaturen und SchmelzenthalpienDie Schmelzenthalpie einer Substanz, auch bekannt als latente Wärme, stellt ein Maß der Energiezufuhr dar, typischerweise Wärme, welche notwendig ist, um eine Substanz vom festen in den flüssigen Zustand zu überführen. Der Schmelzpunkt einer Substanz ist die Temperatur, bei der die Substanz von einem festen (kristallinen) in den flüssigen Zustand (isotrope Schmelze) übergeht.Schmelzenthalpie von 178 J/g und eine Temperatur für den extrapolierten Onset von 138,5 °C. Aus Abbildung 4 ist aber auch deutlich erkennbar, dass das Wärmestromsignal den Beginn des Schmelzvorgangs der Probe bereits bei deutlich tieferen Temperaturen anzeigt als dies die normenkonforme Auswertung für den extrapolierten Onset ermittelt. In der Literatur werden zwei polymorphe Formen der Acetylsalicylsäure beschrieben, wobei die Form I mit einer Schmelztemperaturen und SchmelzenthalpienDie Schmelzenthalpie einer Substanz, auch bekannt als latente Wärme, stellt ein Maß der Energiezufuhr dar, typischerweise Wärme, welche notwendig ist, um eine Substanz vom festen in den flüssigen Zustand zu überführen. Der Schmelzpunkt einer Substanz ist die Temperatur, bei der die Substanz von einem festen (kristallinen) in den flüssigen Zustand (isotrope Schmelze) übergeht.Schmelztemperatur von 144,9 °C und die Form II mit einer Schmelztemperatur von 135,5 °C angegeben wird [5, 6].
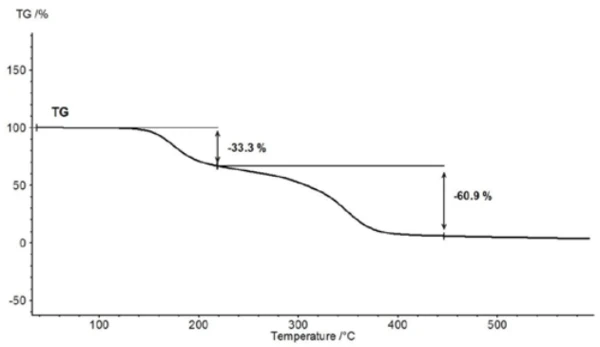
Oberhalb von etwa 150 °C beginnt die Acetylsalicylsäure mit dem thermischen Abbau. Für die weitergehende Charakterisierung oberhalb des Schmelzpunkts ist deshalb die Thermogravimetrie (TG) besser geeignet (Abbildung 5).
Für die Charakterisierung des thermischen Abbaus wurde ein Stück einer Aspirintablette mit Hilfe der TG-FT-IR Kopplung untersucht. Zwar ist aus den thermogravimetrischen Ergebnissen zwischen 150 °C und 450 °C eine zweistufige thermische Abbaureaktion zu erkennen und die Mengen an freigesetzten Gasen lassen sich quantifizieren, aber einen Hinweis darauf, welche Gase für den detektieren Massenverlust verantwortlich sind, ist ohne eine spektroskopische Analyse nicht möglich. Führt man eine Messung durch, bei der die Thermowaage mit einem Infrarotspektrometer gekoppelt ist, so kann die Gasphase während der gesamten Messung kontinuierlich untersucht werden. In Abbildung 6 sind alle Infrarotspektren in einer dreidimensionalen Anordnung temperaturskaliert dargestellt. In der linken hinteren Fläche sind zudem die Ergebnisse der thermogravimetrischen Messung zu erkennen.
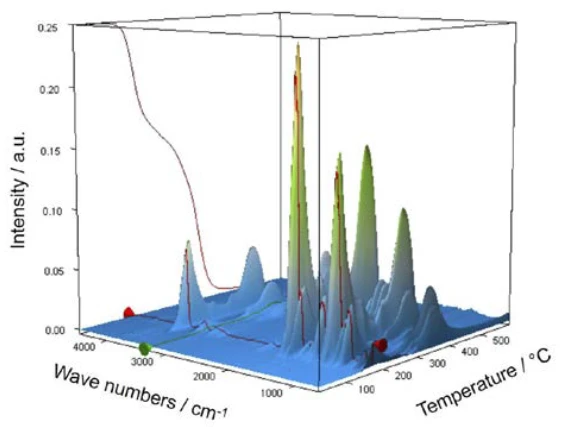
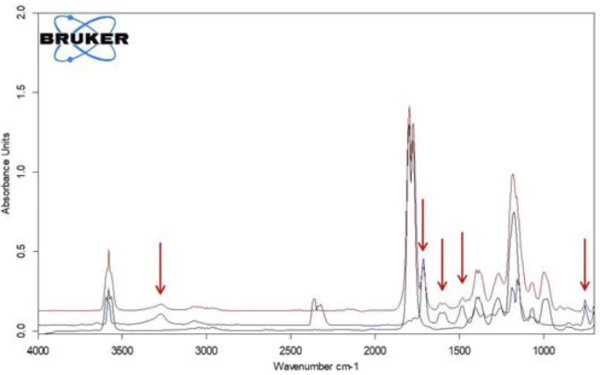
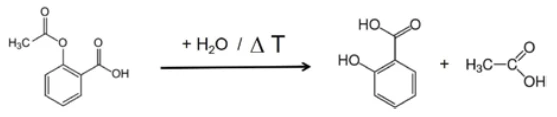
Extrahiert man aus dieser Darstellung Einzelspektren bei den Temperaturen mit den jeweils höchsten Absorptionsintensitäten, so lassen sich die freigesetzten Gase mit Hilfe von Vergleichsspektren aus Gasphasenbibliotheken identifizieren. Das für die erste Massenverluststufe bei 180 °C charakteristische Einzelspektrum stimmt sehr gut mit dem Spektrum von Essigsäure aus der EPA-NIST Gasphasenbibliothek überein (Abbildung 7). Die roten Pfeile markieren Absorptionsbanden, die nicht zur Essigsäure passen, aber sehr gut mit den Absorptionsbanden der Salicylsäure (EPA-NIST) übereinstimmen. Das legt die Vermutung nahe, dass sich Acetylsalicylsäure, analog der Reaktionsgleichung 1, thermisch in Salicylsäure und Essigsäure abbaut. Bei 180 °C liegt die gebildete Essigsäure bereits gasförmig vor, während die Salicylsäure mit einem Schmelzpunkt von 159 °C zu verdampfen beginnt. Dies ist sicher auch der Grund, warum die erste Massenverluststufe direkt in die folgende Stufe übergeht. Die Kombination aus Zersetzung und VerdampfungVerdampfung beschreibt die Phasenumwandlung eines Stoffes von der flüssigen in die gasförmige Phase. Beim Verdampfen eines Stoffes unterscheidet man grundsätzlich zwei Formen, Sieden und Verdunstung.Verdampfung bestätigt den von Rebeiro et al. vorgeschlagenen Abbaumechanismus [7].
Im Zusammenhang mit der Darreichungsform des Wirkstoffs Acetylsalicylsäure als Tablette wird neben den Zuschlagsstoffen wie Stärke und Magnesiumstearat-Monohydrat auch der Einfluss von Feuchtigkeit auf die Reaktionsprodukte des thermischen Abbaus betont. Gupchup et al. weisen jedoch darauf hin, dass der trockene Wirkstoff Acetylsalicylsäure durch Dimerisierung im Sinne einer Kondensation auch selbst für das Vorhandensein von Wasser sorgen kann [8].
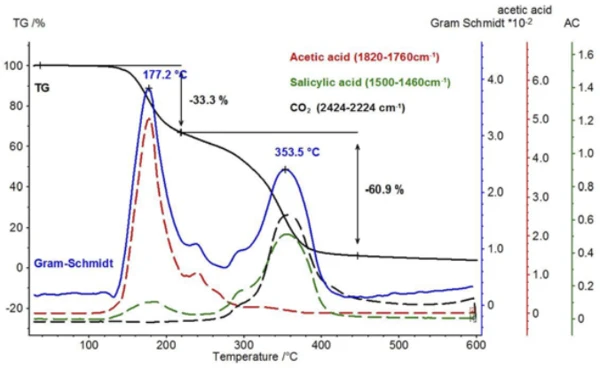
Beim Vergleich der beiden Spektren der Essigsäure und der Salicylsäure fällt auf, dass die Absorptionsintensitäten im Bereich zwischen 1760 cm-1 und 1820 cm-1 einzig der Essigsäure zuzuordnen sind, während der Absorptionsbereich zwischen 1460 cm-1 und 1500 cm-1 die Salicylsäure repräsentiert. Berechnet man den Intensitätsverlauf in diesen Absorptionsbereichen in Abhängigkeit von der Temperatur, erhält man für jede Substanz sogenannte Spuren (traces), die zu deren temperaturabhängig freigesetzten Mengen proportional sind.
(Gleichung 1)
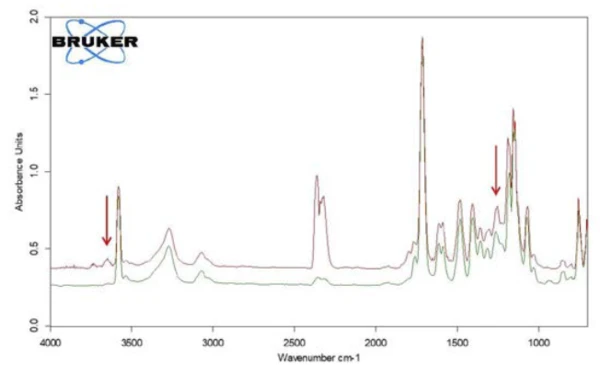
Ein Vergleich dieser temperaturabhängigen Spuren für Essigsäure und Salicylsäure mit der Gram-Schmidt-Spur (Summe der wellenlängenunabhängigen Intensitäten) und dem TG-Signal ist in Abbildung 8 gezeigt. Analog zum TG-Signal erkennt man auch aus der Gram-Schmidt- Spur, dass die erste Massenverluststufe direkt und ohne Plateau in die zweite Massenverluststufe übergeht. Den Grund dafür kann man den Spuren der beiden Produkte entnehmen, die erkennen lassen, dass die Freisetzung von Essigsäure bis etwa 300 °C nachweisbar ist und zusätzlich die Verdampfung von Salicylsäure bereits bei tieferen Temperaturen beginnt. Neben der Salicylsäure kann mit dem temperaturabhängigen Verlauf der Absorptionsintensitäten auch die Entstehung von Kohlendioxid nachgewiesen werden. Bestätigt wird dies durch das extrahierte Einzelspektrum bei 360 °C (Abbildung 9).
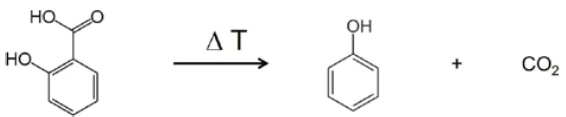
Im Bereich zwischen 2424 und 2224 Wellenzahlen sind die Absorptionsintensitäten von CO2 deutlich zu erkennen. Zusätzlich gibt es Hinweise auf die Bildung von Phenol. Die Positionen der intensivsten Absorptionsbanden für Phenol sind mit roten Pfeilen markiert. Es kann daher angenommen werden, dass neben der Verdampfung von Salicylsäure auch ein Zersetzungsprozess stattfindet, der analog zu Gleichung 2 die Bildung von Phenol und CO2 nahelegt.
(Equation 2)
Zusammenfassung
Acetylsalicylsäure wurde mittels FT-IR-Spektroskopie bei Raumtemperatur (ATR) untersucht und die erhaltenen FT-IR-Spektren durch einen Vergleich mit einer Spektrenbibliothek zur Identifizierung herangezogen. Die DSC kam zur Untersuchung des Schmelzverhaltens zum Einsatz. Zusätzlich konnte das thermische Verhalten von Aspirin® mittels TG-FT-IR charakterisiert werden. Die Spektren, der bei der thermischen Behandlung freigesetzten Gase, wurden mit einer Gasphasenbibliothek abgeglichen und so die Produkte identifiziert. Literaturbekannte Abbaumechanismen konnten auf diese Weise bestätigt werden, und es wurde zusätzlich gezeigt, dass die gängigen Hilfsstoffe bei der Tablettierung von Aspirin® offensichtlich keinen detektierbaren Einfluss auf die Bildung der gasförmigen Abbauprodukte haben.