Introduzione
Già le prime culture elevate utilizzavano la corteccia di salice come rimedio per la febbre e il dolore [1]; lo studioso romano Plinio il Vecchio considerava la corteccia di salice come una medicina e i Teutoni e i Celti producevano estratti dalla cottura della corteccia di salice, i cui ingredienti erano chimicamente correlati all'acido acetilsalicilico sintetico [2]. Sebbene nel XIX secolo diversi chimici fossero in grado di produrre salicina e acido salicilico, solo nel 1897 Felix Hoffmann riuscì a sintetizzare l'acido acetilsalicilico senza impurità presso la sede della BAYER a Wuppertal-Elberfeld, in Germania. Kurt Wittauer (figura 2) sperimentò questo farmaco sui pazienti negli anni successivi, finché la BAYER (figura 1) non depositò il relativo brevetto nel 1921. L'antidolorifico iniziò il suo trionfale successo in tutto il mondo e oggi la BAYER produce più di 50.000 tonnellate di acido acetilsalicilico all'anno [4].


I farmaci contenenti il principio attivo acido acetilsalicilico sono disponibili in varie forme farmaceutiche e vengono impiegati non solo per il loro effetto analgesico, ma anche per le loro proprietà antinfiammatorie, antipiretiche e antiaggreganti.
L'acido acetilsalicilico puro è una polvere bianca poco solubile in acqua, ha un Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione di 136°C e si decompone a temperature più elevate. In questo lavoro sono stati impiegati vari metodi di analisi termica, spettroscopia infrarossa e combinazioni di entrambi per studiare i prodotti di Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione gassosa.
Metodi e preparazione
L'acido acetilsalicilico (CAS: 50-78-2) è stato acquistato da Sigma Aldrich con una purezza > 99%. Per l'indagine della sostanza originale, è stato utilizzato il BRUKER TENSOR II per misurare i campioni con la riflessione totale attenuata (ATR). NETZSCH Per la determinazione del comportamento diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione, è stato utilizzato il DSC 214 Polyma. Per la caratterizzazione termica dei gas rilasciati, una termobilancia è stata accoppiata a uno spettrometro a infrarossi - NETZSCH TG 209 F1 Libra® al Bruker Equinox 55/S. Le condizioni di misurazione per le indagini termoanalitiche e spettroscopiche sono riassunte nelle tabelle da 1 a 3.
Tabella 1: Condizioni di misurazione per l'indagine DSC dell'acido acetilsalicilico
| Acido acetilsalicilico | |
|---|---|
| Massa del campione | 2.08 mg |
| Materiale del crogiolo | Alluminio, forato |
| Massa del crogiolo | 52.75 mg |
| Intervallo di temperatura | 25 ... 160°C |
| Velocità di riscaldamento | 7 K/min |
| Atmosfera | Azoto (50 ml) |
Tabella 2: Condizioni di misurazione per l'indagine termogravimetrica di una compressa di Aspirina® mediante TGA-FT-IR
| Aspirina® | |
|---|---|
| Massa del campione | 9.141 mg |
| Materiale del crogiolo | Allumina, aperto |
| Massa del crogiolo | 162.75 mg |
| Intervallo di temperatura | 25 ... 600°C |
| Velocità di riscaldamento | 10 K/min |
| Atmosfera | Azoto (40 ml) |
| Scansioni | 32 |
| Risoluzione | 4 cm-1 |
| Intervallo spettrale | 650 - 4500 cm-1 |
Tabella 3: Condizioni di misurazione per l'indagine spettroscopica di (ATR) dell'acido acetilsalicilico
| Acido acetilsalicilico | |
|---|---|
| Rivelatore | DTGS |
| Scansioni | 32 |
| Risoluzione | 4 cm-1 |
| Intervallo spettrale | 650 - 4500 cm-1 |
Risultati e discussione
L'indagine del principio attivo acido acetilsalicilico con l'ausilio della spettroscopia FT-IR produce uno spettro infrarosso a temperatura ambiente che è in buon accordo con lo spettro library (Bruker ATR-LIBPolymers-1-472-2) (figura 3). Il range diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione dell'acido acetilsalicilico è indicato dal produttore come compreso tra 134°C e 136°C. L'indagine mediante calorimetria differenziale a scansione (DSC) fornisce un'entalpia diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione di 178 J/g e una temperatura di insorgenza estrapolata pari a 138,5°C. Come si può vedere chiaramente anche dalla figura 4, il segnale di flusso di calore indica l'inizio del processo diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione del campione già a temperature significativamente più basse rispetto a quelle determinate dalla valutazione standard conforme per l'insorgenza estrapolata. In letteratura sono descritte due forme polimorfiche di acido acetilsalicilico: Forma I con unaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). temperatura di fusione di 144,9°C e Forma II con unaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). temperatura di fusione di 135,5°C [5, 6].
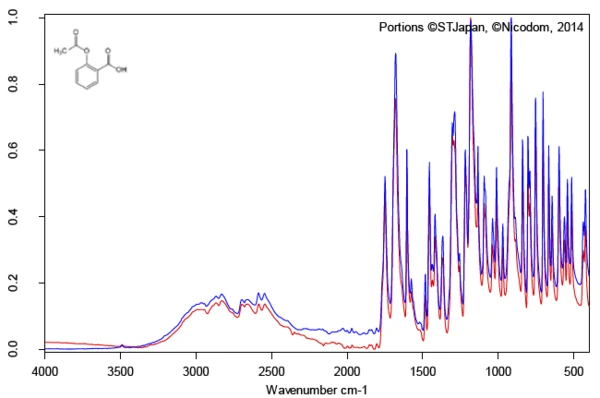
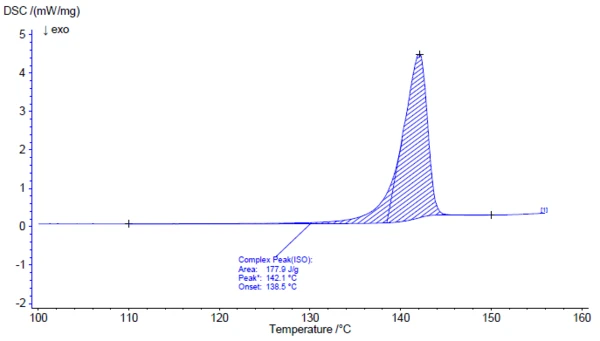
Al di sopra di circa 150°C, inizia la degradazione termica dell'acido acetilsalicilico. Pertanto, la termogravimetria (TGA) è più adatta per un'ulteriore caratterizzazione al di sopra del Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione (figura 5).
Per la caratterizzazione della degradazione termica, è stato analizzato un pezzo di compressa di aspirina con l'aiuto dell'accoppiamento TGA-FT-IR. Sebbene i risultati termogravimetrici tra 150°C e 450°C mostrino una reazione di degradazione termica in due fasi e le quantità di gas rilasciate possano essere quantificate, non è possibile determinare quali gas siano responsabili della perdita di massa rilevata senza un'analisi spettroscopica. Se si esegue una misura in cui la termobilancia è accoppiata a uno spettrometro a infrarossi, la fase gassosa può essere analizzata continuamente durante l'intera misura. Tutti gli spettri all'infrarosso sono presentati in una disposizione tridimensionale, in scala di temperatura, nella figura 6. I risultati della misura termogravimetrica sono visibili anche nell'area posteriore sinistra.
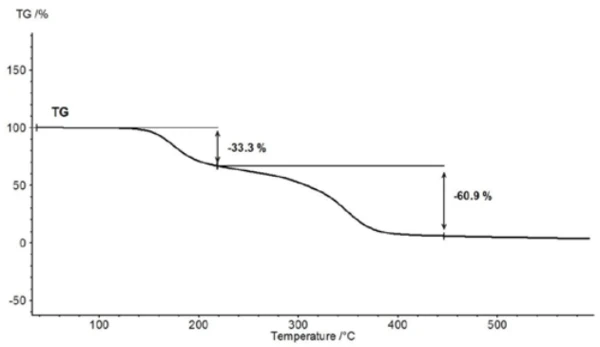
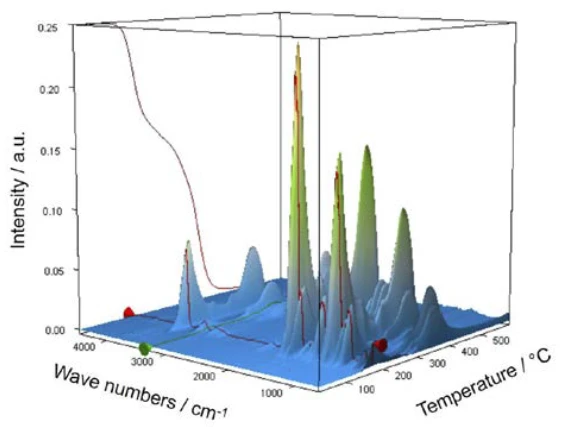
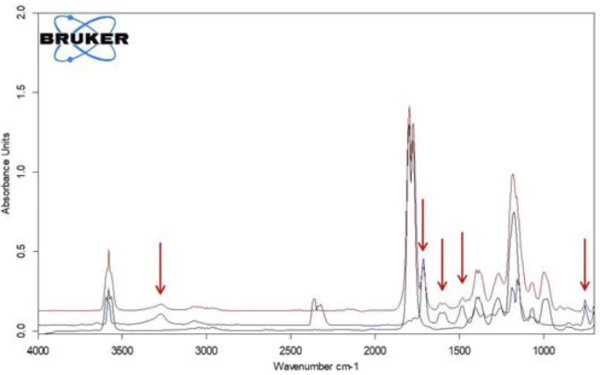
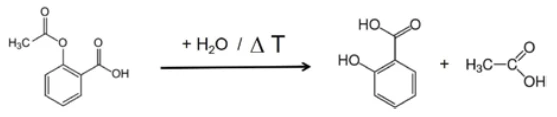
Se da questa presentazione si estraggono gli spettri individuali alle temperature con le intensità di assorbimento più elevate, i gas rilasciati possono essere identificati con l'aiuto di spettri di confronto provenienti da libraries in fase gassosa. Lo spettro individuale per la prima fase di perdita di massa a 180°C, che è caratteristico, è in ottimo accordo con lo spettro dell'acido acetico proveniente dalla fase gassosa di EPANIST libra(figura 7). Le frecce rosse indicano bande di assorbimento che non corrispondono all'acido acetico, ma corrispondono molto bene alle bande di assorbimento dell'acido salicilico (EPA-NIST). Questo porta a ipotizzare che l'acido acetilsalicilico, come nell'equazione di reazione 1, si degradi termicamente in acido salicilico e acido acetico (equazione 1). A 180°C, l'acido acetico formato è già gassoso mentre l'acido salicilico, con un Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione di 159°C, inizia a evaporare. Questo è certamente anche il motivo per cui la prima fase di perdita di massa passa direttamente alla fase successiva. La combinazione di Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione ed evaporazione conferma il meccanismo di degradazione proposto da Rebeiro et al. [7]. In relazione alla forma in compresse del principio attivo acido acetilsalicilico, viene sottolineata l'influenza dell'umidità sui prodotti di reazione della degradazione termica e di additivi quali starch e magnesio stearato monoidrato. Gupchup et al., tuttavia, sottolineano che il principio attivo secco dell'acido acetilsalicilico può di per sé garantire la presenza di acqua attraverso la dimerizzazione nel senso della condensazione [8].
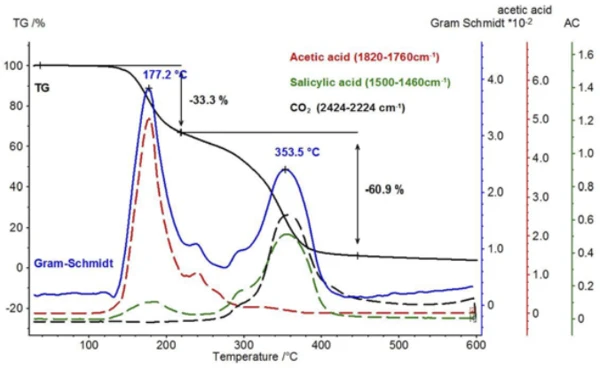
Confrontando i due spettri dell'acido acetico e dell'acido salicilico, si nota che le bande di assorbimento nell'intervallo tra 1760 cm-1 e 1820 cm-1 possono essere attribuite solo all'acido acetico, mentre le bande di assorbimento tra 1460 cm-1 e 1500 cm-1 rappresentano l'acido salicilico. Se si calcola l'andamento dell'intensità degli intervalli di assorbimento in funzione della temperatura, si ottengono "tracce" per ciascuna sostanza, proporzionali alle corrispondenti quantità rilasciate in funzione della temperatura.
(Equazione 1)
La figura 8 mostra un confronto di queste tracce dipendenti dalla temperatura per l'acido acetico e l'acido salicilico con la traccia di Gram-Schmidt (somma delle intensità che non dipendono dalla lunghezza d'onda) e il segnale TGA. Come per il segnale TGA, la traccia di Gram-Schmidt rivela che la prima fase di perdita di massa passa direttamente e senza plateau alla seconda fase di perdita di massa. La ragione di ciò è da ricercare nelle tracce dei due prodotti, che mostrano che il rilascio di acido acetico può essere rilevato fino a circa 300°C e, inoltre, l'evaporazione dell'acido salicilico inizia già a temperature inferiori.
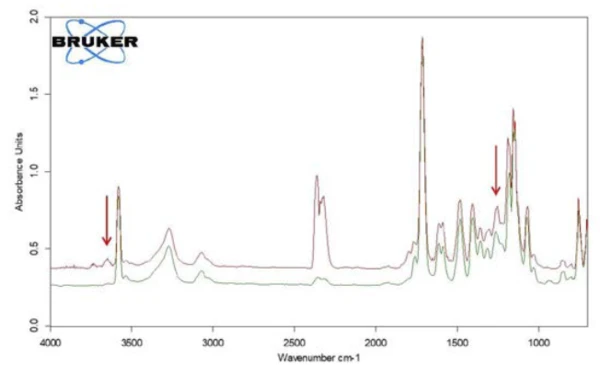
Oltre all'acido salicilico, anche la formazione di anidride carbonica può essere rilevata attraverso l'andamento delle intensità di assorbimento in funzione della temperatura. Ciò è confermato dallo spettro individuale estratto a 360°C (figura 9).
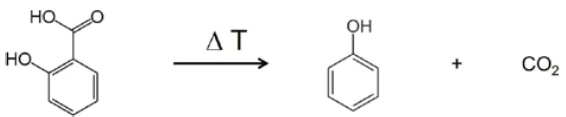
Nell'intervallo tra i numeri d'onda 2424 e 2224 sono chiaramente visibili le bande di assorbimento dellaCO2. Inoltre, vi sono indicazioni della formazione di fenolo. Le posizioni delle bande di assorbimento più intense del fenolo sono contrassegnate da frecce rosse. Si può quindi ipotizzare che, oltre all'evaporazione dell'acido salicilico, avvenga anche un processo di Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione; ciò suggerisce la formazione di fenolo eCO2, come mostrato nell'equazione 2.
(Equazione 2)
Sintesi
L'acido acetilsalicilico è stato studiato mediante spettroscopia FT-IR a temperatura ambiente (ATR) e gli spettri FT-IR ottenuti sono stati utilizzati per l'identificazione mediante confronto con uno spettro library. Il DSC è stato utilizzato per indagare il comportamento diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione. Inoltre, il comportamento termico dell'Aspirina® è stato caratterizzato mediante TGA-FT-IR. Gli spettri dei gas rilasciati durante il trattamento termico sono stati confrontati con una fase gassosa libraper l'identificazione dei prodotti. È stato così possibile confermare i meccanismi di degradazione noti in letteratura ed è stato inoltre dimostrato che gli additivi comunemente utilizzati per la produzione di Aspirina® non sembrano avere un'influenza rilevabile sulla formazione dei prodotti di Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione gassosa.