Введение
При нагревании жидкостей в термобаллоне давление паров жидкости также повышается при увеличении скорости нагрева. Скорость испарения - скорость перехода жидкости в газовую фазу - увеличивается с ростом температуры. Скорость потери массы, позволяющая отслеживать испарение в термобаллоне, увеличивается в той же степени. Термобаллон может работать при нормальном давлении в потоке продувочного газа, вымывающего образующиеся газы из камеры образца.
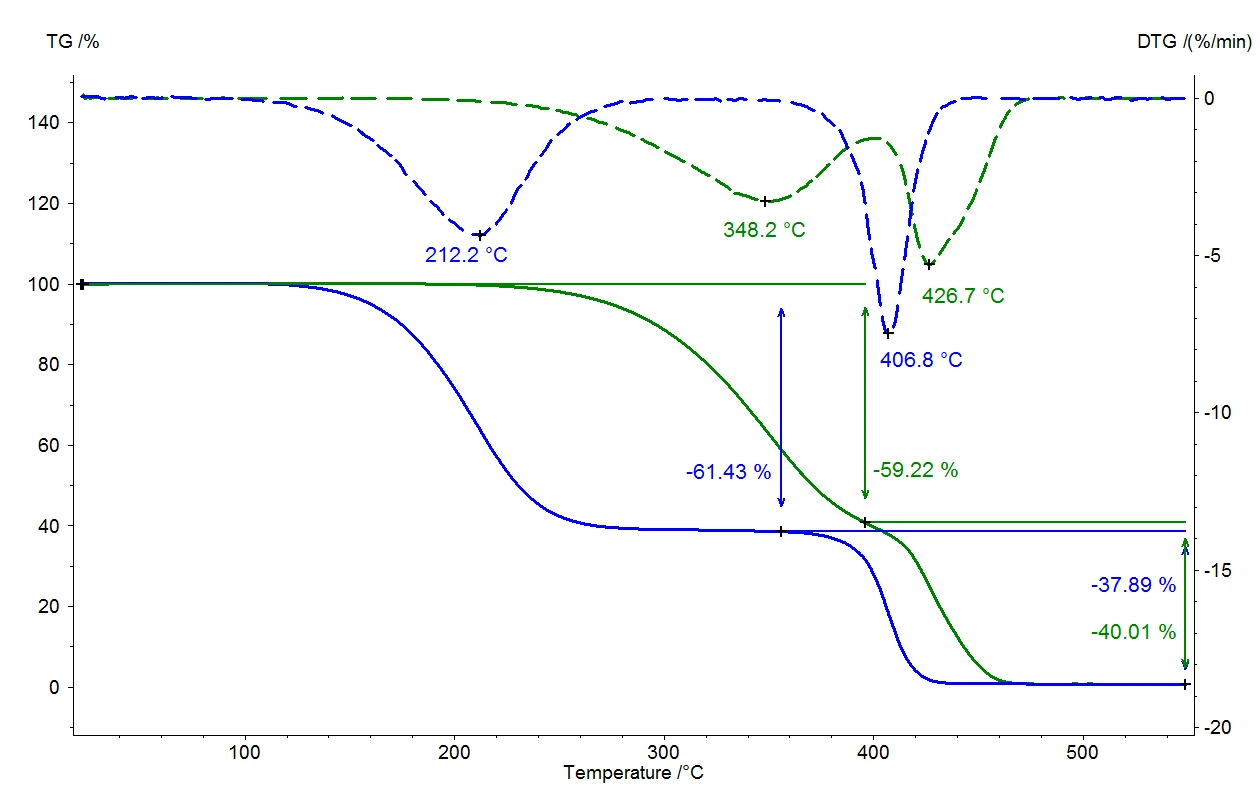
Жидкость закипает, когда давление паров жидкости соответствует давлению окружающей среды. При нормальном давлении (1013 мбар) вода закипает при 100°C, поскольку давление паров также составляет 1013 мбар. Если давление окружающей среды изменится, то изменится и температура кипения. На рисунке 1 представлена эта зависимость для воды в диапазоне температур от комнатной до 110°C [1].
Как хорошо видно на рисунке 1, вода закипает уже при 50°C, если давление окружающей среды, составляющее 1013 мбар, снижается до 123 мбар. Это соотношение используется в таких областях, как вакуумная сушка, когда высушиваемый материал подвергается воздействию давления ниже атмосферного, а жидкость (обычно вода) может мягко испаряться при низких температурах. Этот метод особенно часто используется в пищевой промышленности.
Существует также взаимосвязь, аналогичная описанному снижению температуры кипения жидкостей - хотя и в несколько более слабой форме - для сублимации и разложения твердых веществ.
Условия измерения
| Образец | SEBS | SEBS |
|---|---|---|
| Вес | 8.635 мг | 10.130 мг |
| Тигель | Al2O3 | Al2O3 |
| Атмосфера | Азот | Вакуум |
| Скорость потока газа | 40 мл/мин | 0 мл/мин |
| Скорость нагрева | 5 К/мин | 5 К/мин |
Термогравиметрические исследования при пониженном давлении
Как и в случае с кипячением, другие реакции, в ходе которых выделяются газообразные вещества, также зависят от давления окружающей среды. Температурные диапазоны реакций разложения также смещаются к более низким значениям с уменьшением давления окружающей среды. Этот сдвиг температуры зависит от процесса или вещества. В свою очередь, это означает, что применение атмосферы с отрицательным давлением может в разной степени влиять на выделение газообразных продуктов разложения для различных реакций. Эта процедура может быть особенно полезна, если процессы термической деградации накладываются друг на друга, то есть протекают в очень близком временном интервале друг от друга. Снижение давления окружающей среды позволяет улучшить разделение перекрывающихся событий.
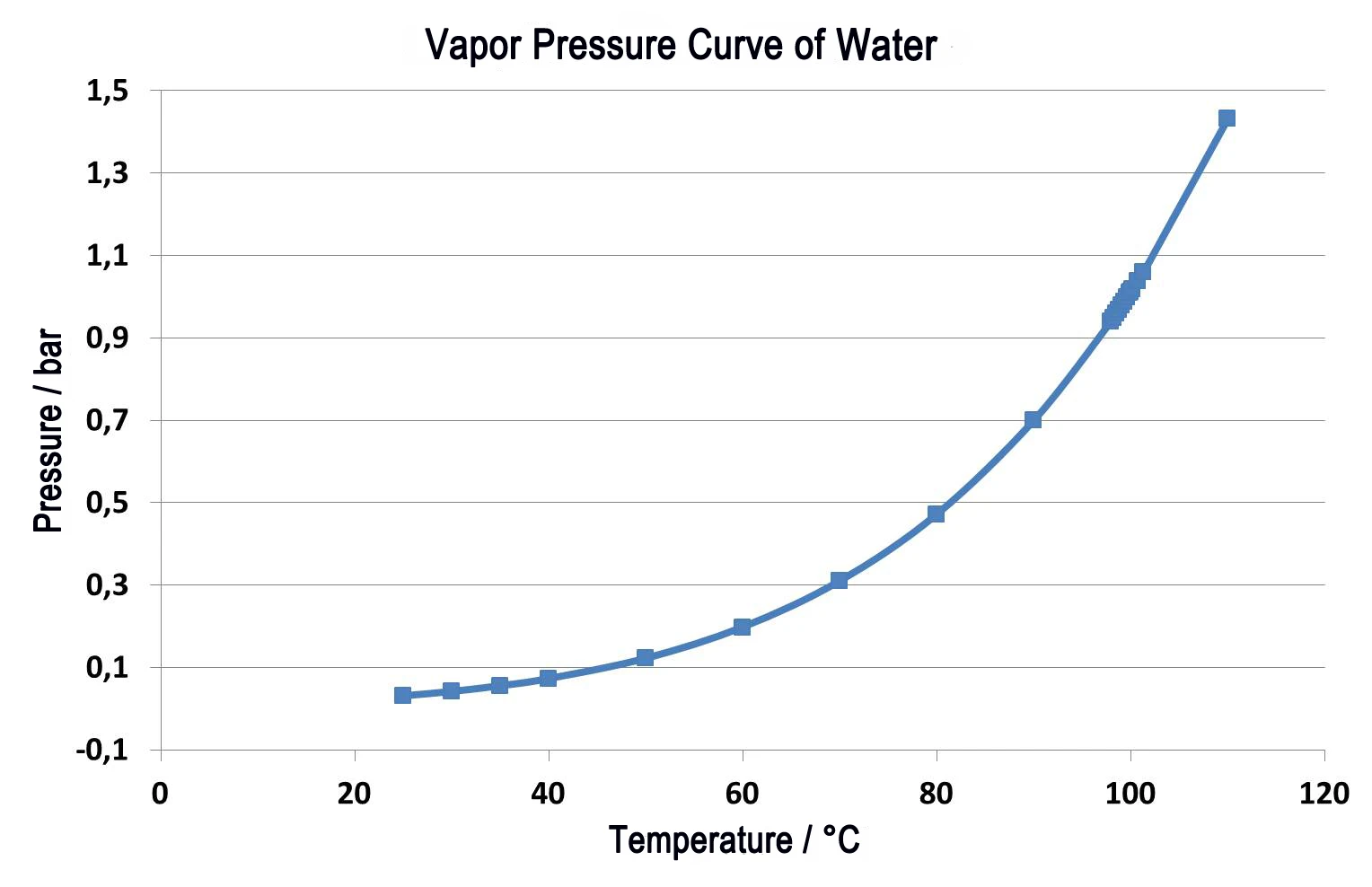
На рис. 2 показано сравнение двух измерений на термопластичном эластомере. Сплошные линии представляют собой относительное изменение массы в зависимости от температуры. Зеленая кривая показывает результаты измерений при нормальном давлении и скорости продувочного газа в азоте 40 мл/мин. Видны две ступени потери массы; они перекрываются даже при низкой скорости нагрева 5 К/мин. Количественное определение ступеней в данном случае затруднительно. Если провести это исследование в вакууме - при той же скорости нагрева 5 К/мин (синяя кривая) - все температуры выделения сдвигаются к более низким значениям, чем при измерении под нормальным давлением. При нормальном давлении конец реакции достигается при 480°C, но в вакууме реакция завершается уже при 440°C. Пунктирные кривые (DTG) показывают первую производную для каждого из относительных изменений массы (TG). Результаты DTG указывают на скорость потери массы и, следовательно, являются показателем скорости реакции. Температуры максимальных скоростей потери массы (максимумы DTG) подтверждают, что обе частичные реакции смещаются к более низким температурам, когда происходят в вакууме. Однако, поскольку первая парциальная реакция (348°C - 212°C) протекает при значительно более низких температурах, чем вторая (427°C - 407°C), эти две парциальные реакции лучше разделены. Таким образом, значительно облегчается количественная оценка двух этапов потери массы.