Einleitung
Erhitzt man Flüssigkeiten in der Thermowaage, so wird mit der Aufheizrate auch der Dampfdruck der Flüssigkeit zunehmen. Die Geschwindigkeit, mit der die Flüssigkeit in die Gasphase übergeht, die Verdampfungsrate, nimmt mit steigender Temperatur zu. In gleichem Maße nimmt auch die Massenverlustrate zu, über die sich in der Thermowaage die VerdampfungVerdampfung beschreibt die Phasenumwandlung eines Stoffes von der flüssigen in die gasförmige Phase. Beim Verdampfen eines Stoffes unterscheidet man grundsätzlich zwei Formen, Sieden und Verdunstung.Verdampfung verfolgen lässt. Die Thermowaage arbeitet unter Normaldruck in einem Spülgasstrom, der die entstehenden Gase aus dem Probenraum ausspült.
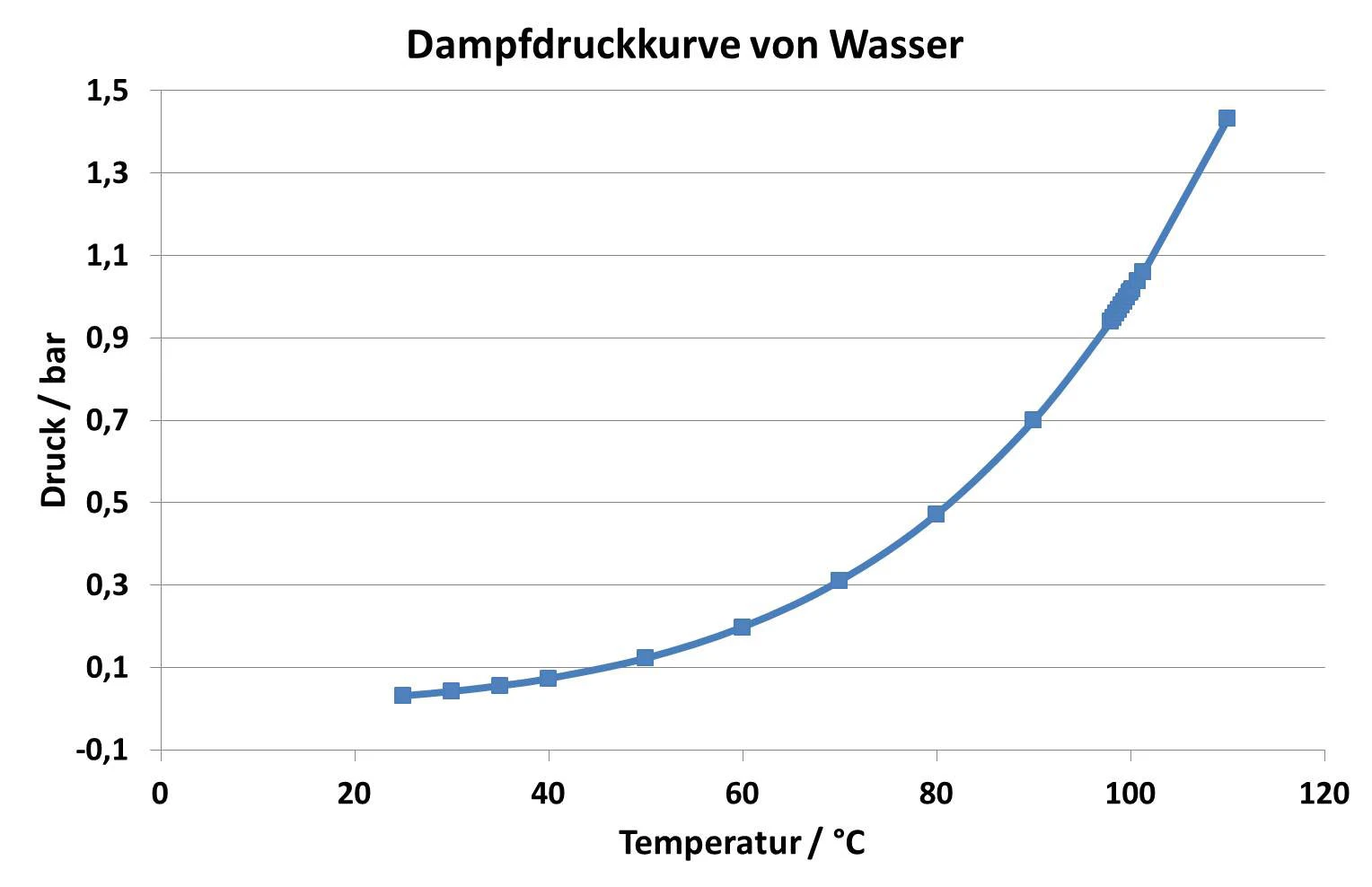
Eine Flüssigkeit siedet, wenn der Dampfdruck der Flüssigkeit dem Umgebungsdruck entspricht. Unter Normaldruck (1013 mbar) siedet Wasser bei 100 °C, weil der Dampfdruck von Wasser bei 100 °C ebenfalls 1013 mbar beträgt. Verändert sich der Umgebungsdruck, so ändert sich auch die Siedetemperatur. Für Wasser ist dieser Zusammenhang in Abbildung 1 für den Temperaturbereich zwischen Raumtemperatur und 110 °C dargestellt [1].
Aus Abbildung 1 wird deutlich, dass Wasser bereits bei 50 °C siedet, wenn man den Umgebungsdruck von 1013 mbar auf 123 mbar reduziert. Diesen Zusammenhang macht man sich beispielsweise in der Vakuumtrocknung zu Nutze, indem man das Trockengut einem Unterdruck aussetzt und somit bei niedrigeren Temperaturen Flüssigkeiten (in den meisten Fällen Wasser) schonend verdampfen kann. Dieses Verfahren kommt besonders häufig im Lebensmittelbereich zum Einsatz.
Ein ähnlicher Zusammenhang wie die beschriebene Herabsetzung der Siedetemperatur von Flüssigkeiten besteht, wenn auch in abgeschwächter Form, für die Sublimation und die Zersetzung von Feststoffen.
Messbedingungen
| Probe | SEBS | SEBS |
|---|---|---|
| Einwaage | 8.635 mg | 10.130 mg |
| Tiegel | Al2O3 | Al2O3 |
| Atmosphäre | Stickstoff | Vakuum |
| Gasflussrate | 40 ml/min | 0 ml/min |
| Heizrate | 5 K/min | 5 K/min |
Thermogravimetrische Untersuchungen in reduziertem Druck
Wie der Siedeprozess, so sind auch andere Reaktionen, bei denen gasförmige Substanzen freigesetzt werden, in ähnlicher Weise vom Umgebungsdruck abhängig. Die Temperaturbereiche von Zersetzungsreaktionen werden mit sinkendem Umgebungsdruck auch zu niedrigeren Werten verschoben. Diese Temperaturverschiebung ist für verschiedene Prozesse und für verschiedene Substanzen unterschiedlich. Dieser Umstand birgt die Möglichkeit, durch Anlegen eines Unterdrucks die Freisetzung von gasförmigen Abbauprodukten für verschiedene Reaktionen verschieden stark zu beeinflussen. Besonders vorteilhaft wirkt sich diese Vorgehensweise aus, wenn thermische Abbauprozesse überlagert sind, also zeitnah stattfinden. Dann kann die Reduzierung des Umgebungsdrucks bewirken, dass sich die überlagernden Ereignisse besser voneinander trennen lassen.
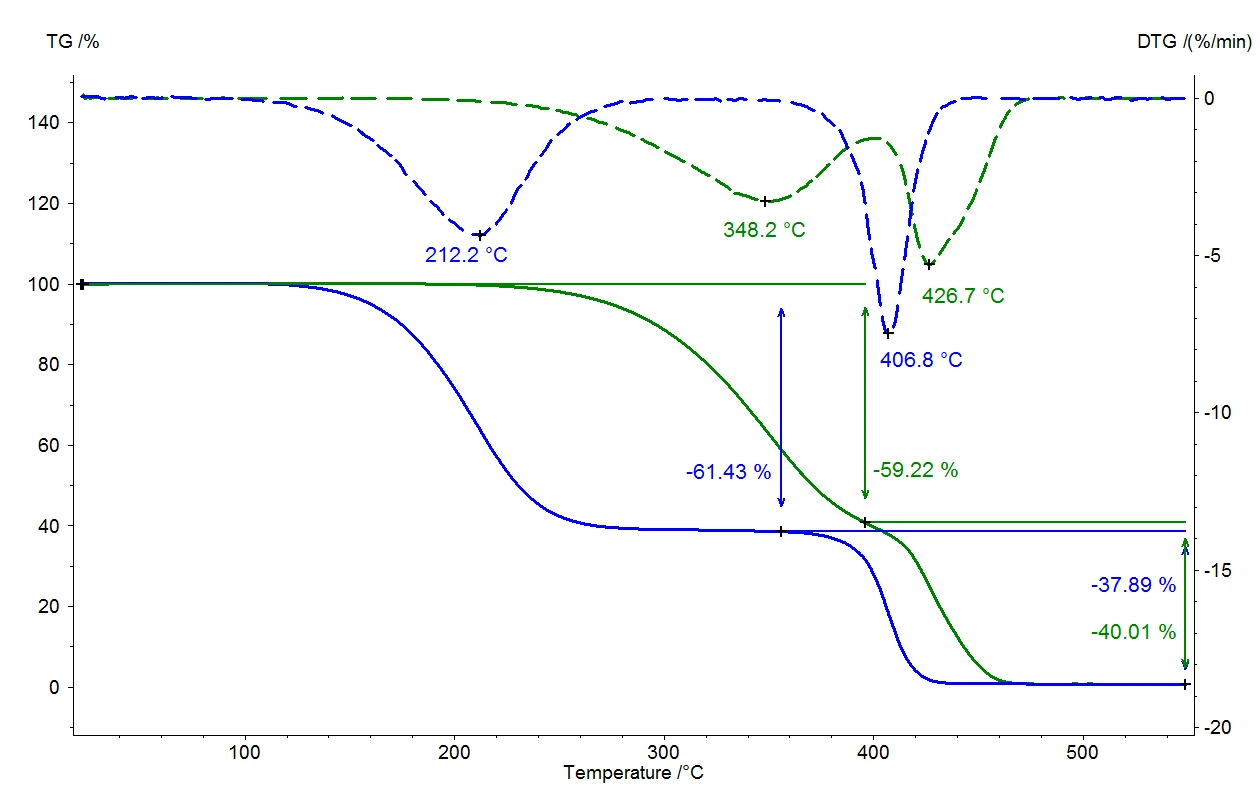
Abbildung 2 zeigt den Vergleich zweier Messungen eines thermoplastischen Elastomers. Die durchgezogenen Linien geben die relativen Massenänderungen in Abhängigkeit von der Temperatur wieder. Die grüne Kurve zeigt die Messergebnisse unter Normaldruck mit einer Spülgasrate von 40 ml/min Stickstoff. Es sind zwei Massenverluststufen zu erkennen, die sich selbst bei der geringen Heizrate von 5 K/min überlagern. Eine Quantifizierung der Stufen ist in diesem Fall schwierig. Führt man die Untersuchung im Vakuum und einer Heizrate von ebenfalls 5 K/min durch (blaue Kurve), so sind im Vergleich zur Messung unter Normaldruck alle Freisetzungstemperaturen zu niedrigeren Werten verschoben. Das Ende der Reaktion wird unter Normaldruck bei 480 °C erreicht, wo hingegen die Reaktion im Vakuum bereits bei 440 °C beendet ist. Die gestrichelten Kurven (DTG) zeigen die jeweils erste Ableitung der relativen Massenänderungen (TG). Die DTG-Ergebnisse geben die Massenverlustrate an und sind somit ein Maß für die Reaktionsgeschwindigkeit. Die Temperaturen der maximalen Massenverlustraten (DTG-Maxima) belegen, dass sich im Vakuum beide Teilreaktionen zu niedrigeren Temperaturen verschieben. Dadurch, dass sich jedoch die erste Teilreaktion (348 °C zu 212 °C) wesentlich stärker zu niedrigeren Temperaturen verschiebt als die zweite (427 °C zu 407 °C), resultiert eine verbesserte Trennwirkung der beiden Teilreaktionen. Die Quantifizierung der beiden Massenverluststufen ist somit wesentlich erleichtert.