Introdução
Ao aquecer líquidos em um termobalanço, a pressão de vapor do líquido também aumenta à medida que a taxa de aquecimento aumenta. A taxa de evaporação - a taxa na qual o líquido passa para a fase gasosa - aumenta com o aumento da temperatura. A taxa de perda de massa, que permite o rastreamento da evaporação em uma termobalança, aumenta na mesma proporção. A termobalança pode ser operada sob pressão normal em um fluxo de gás de purga que elimina os gases formadores da câmara de amostra.
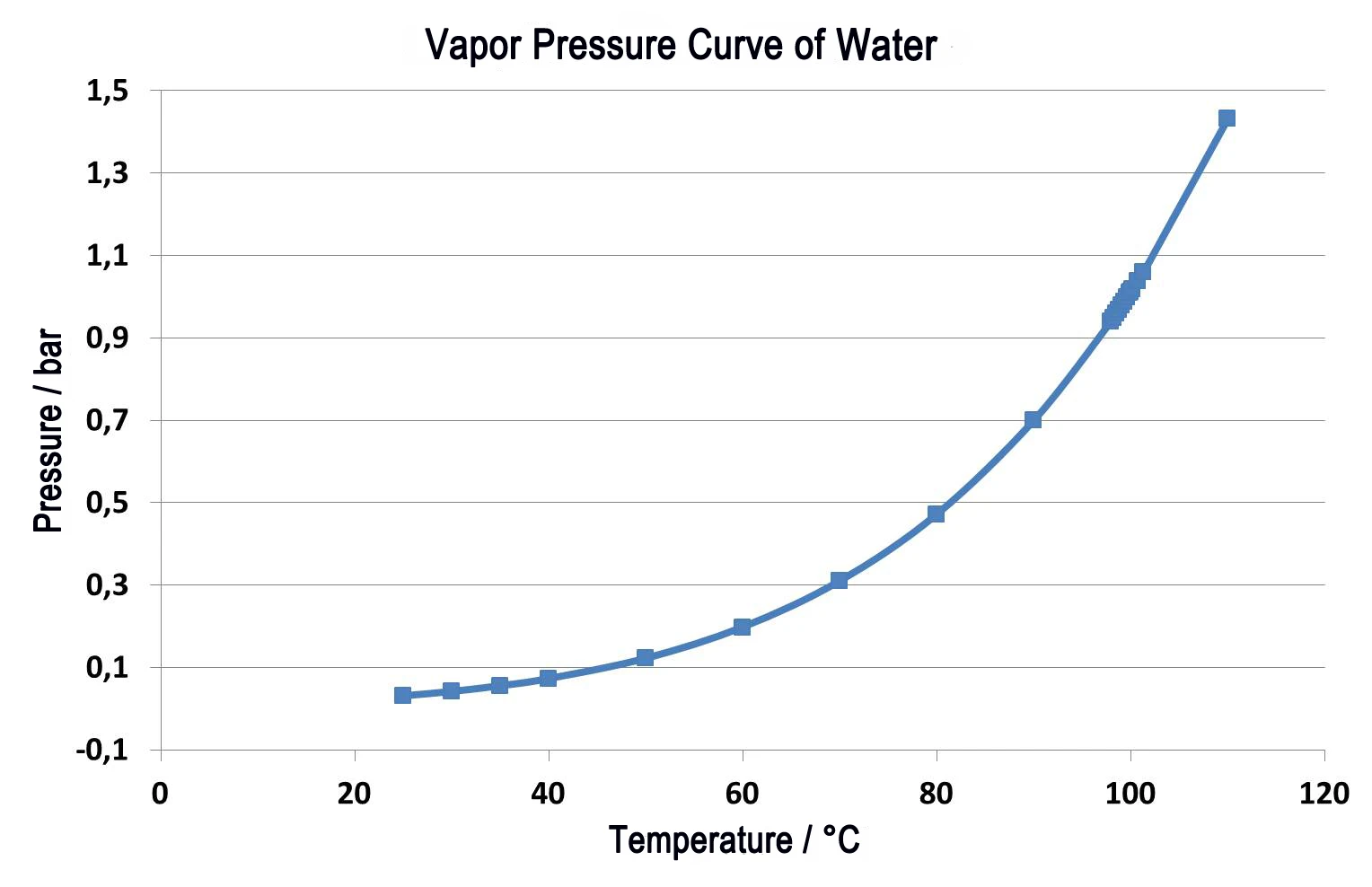
Um líquido entra em ebulição quando a pressão de vapor do líquido corresponde à pressão ambiente. Sob pressão normal (1013 mbar), a água ferve a 100°C, pois a pressão de vapor também é de 1013 mbar. Se a pressão ambiente mudar, a temperatura de ebulição também mudará. A Figura 1 apresenta essa correlação para a água na faixa de temperatura entre a temperatura ambiente e 110°C [1].
Como pode ser visto claramente na figura 1, a água entra em ebulição já a 50°C se a pressão ambiente de 1013 mbar for reduzida para 123 mbar. Essa correlação é usada em aplicações como a secagem a vácuo, em que o material a ser seco é exposto à pressão subambiente, e os líquidos (geralmente água) podem evaporar suavemente em baixas temperaturas. Essa técnica é usada com frequência principalmente no setor alimentício.
Há também uma correlação semelhante à redução descrita do ponto de ebulição para líquidos - embora de forma um pouco mais fraca - para a sublimação e a Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição de sólidos.
Condições de medição
| Amostra | SEBS | SEBS |
|---|---|---|
| Peso | 8.635 mg | 10.130 mg |
| Cadinho | Al2O3 | Al2O3 |
| Atmosfera | Nitrogênio | Vácuo |
| Vazão de gás | 40 ml/min | 0 ml/min |
| Taxa de aquecimento | 5 K/min | 5 K/min |
Investigações termogravimétricas sob pressão reduzida
Assim como no processo de ebulição, outras reações em que substâncias gasosas são liberadas também dependem da pressão ambiente de forma semelhante. As faixas de temperatura das Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. reações de decomposição também mudam para valores mais baixos com a diminuição da pressão ambiente. Essa mudança de temperatura varia de acordo com o processo ou a substância. Por sua vez, isso significa que a aplicação de uma atmosfera de pressão negativa pode influenciar a liberação de produtos de Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição gasosa para diferentes reações em graus variados. Esse procedimento pode ser particularmente benéfico se os processos de degradação térmica estiverem sobrepostos, ou seja, se ocorrerem em uma proximidade temporal muito próxima uns dos outros. A redução da pressão ambiente pode, então, efetuar uma melhor separação dos eventos sobrepostos.
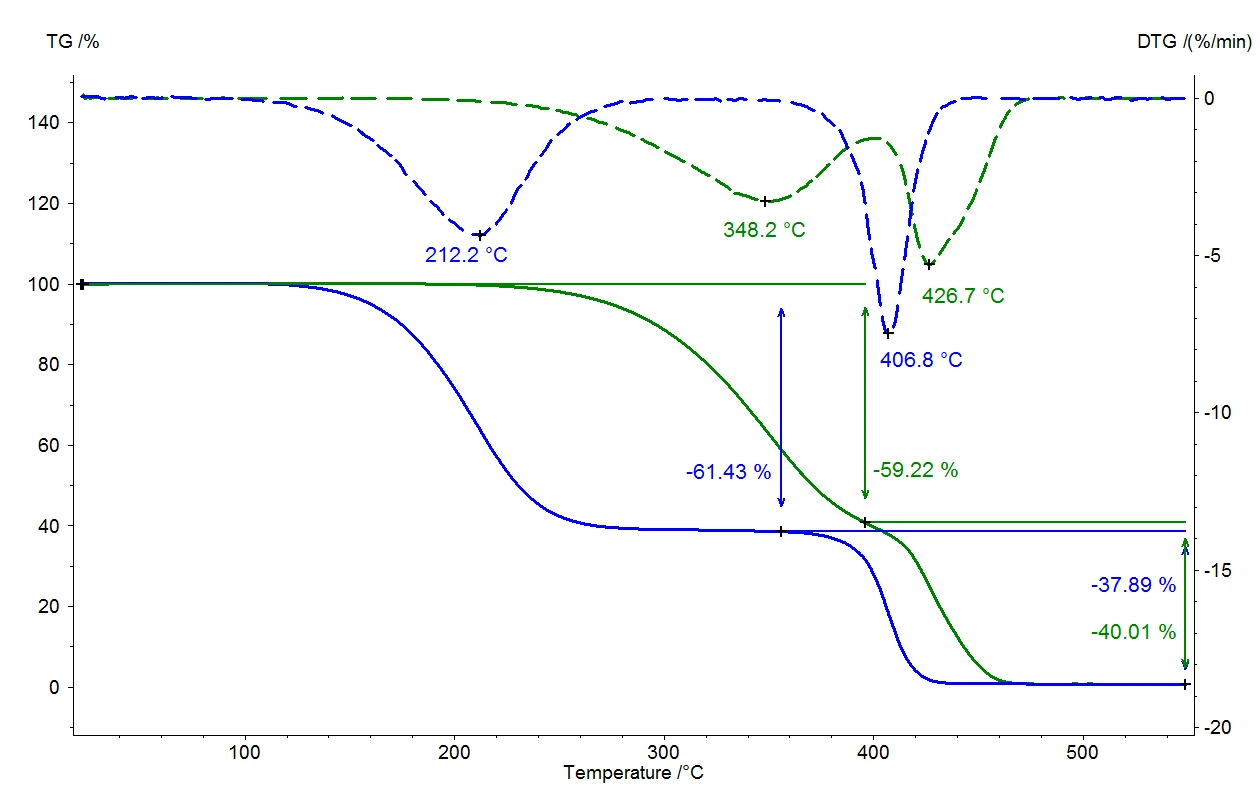
A Figura 2 mostra a comparação de duas medições em um elastômero termoplástico. As linhas sólidas representam a mudança de massa relativa como uma função da temperatura. A curva verde representa os resultados da medição sob pressão normal a uma taxa de gás de purga de 40 ml/min em nitrogênio. Duas etapas de perda de massa podem ser vistas; elas se sobrepõem mesmo com a baixa taxa de aquecimento de 5 K/min. A quantificação das etapas é difícil nesse caso. Se essa investigação for realizada no vácuo - com a mesma taxa de aquecimento de 5 K/min (curva azul) - todas as temperaturas de liberação são deslocadas para valores mais baixos do que na medição sob pressão normal. O fim da reação é alcançado a 480°C sob pressão normal, mas no vácuo, a reação já está concluída a 440°C. As curvas pontilhadas (DTG) mostram a primeira derivada para cada uma das alterações relativas de massa (TG). Os resultados do DTG indicam a taxa de perda de massa e, portanto, são uma medida da taxa de reação. As temperaturas das taxas máximas de perda de massa (máximas de DTG) confirmam que ambas as reações parciais são deslocadas para temperaturas mais baixas quando ocorrem no vácuo. No entanto, como a primeira reação parcial (348°C a 212°C) é deslocada para temperaturas consideravelmente mais baixas do que a segunda (427°C a 407°C), as duas reações parciais são mais bem separadas. A quantificação das duas etapas de perda de massa é, portanto, consideravelmente facilitada.