Giriş
Sıvıların termobalansta ısıtılması, ısıtma hızı arttıkça sıvının buhar basıncı da yükselir. BuharlaşmaBir elementin veya bileşiğin buharlaşması, sıvı fazdan buhara bir faz geçişidir. İki tür buharlaşma vardır: buharlaşma ve kaynama.Buharlaşma hızı - sıvının gaz fazına dönüşme hızı - artan sıcaklıklarla birlikte yükselir. Bir termobalansta buharlaşmanın izlenmesini sağlayan kütle kaybı oranı da aynı derecede artar. Termobalans, oluşan gazları numune odasından dışarı atan bir boşaltma gazı akışında normal basınç altında çalıştırılabilir.
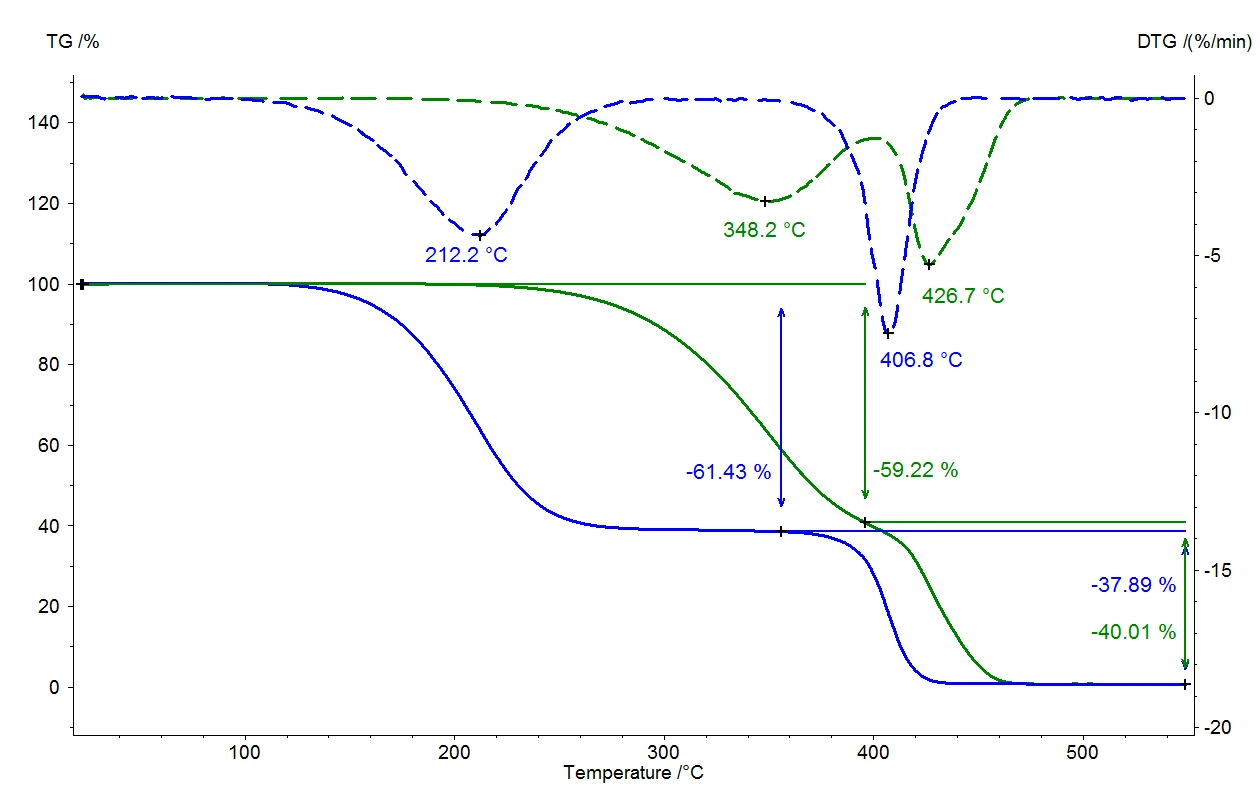
Bir sıvı, sıvının buhar basıncı ortam basıncına karşılık geldiğinde kaynar. Normal basınç altında (1013 mbar) su 100°C'de kaynar, çünkü buhar basıncı da 1013 mbar'dır. Ortam basıncı değişirse, kaynama sıcaklığı da değişecektir. Şekil 1, oda sıcaklığı ile 110°C arasındaki sıcaklık aralığında su için bu korelasyonu göstermektedir [1].
Şekil 1'de açıkça görülebileceği gibi, 1013 mbar'lık ortam basıncı 123 mbar'a düşürülürse su 50°C'de kaynar. Bu korelasyon vakumla kurutma gibi uygulamalarda kullanılır; kurutulacak malzeme ortam basıncının altına maruz bırakılır ve sıvılar (genellikle su) daha sonra düşük sıcaklıklarda yavaşça buharlaşabilir. Bu teknik özellikle gıda sektöründe sıklıkla kullanılmaktadır.
Katıların süblimleşmesi ve ayrışması için de - biraz daha zayıf bir biçimde de olsa - sıvılar için kaynama noktasının açıklanan azalmasına benzer bir korelasyon vardır.
Ölçüm Koşulları
| Örnek | SEBS | SEBS |
|---|---|---|
| Ağırlık | 8.635 mg | 10.130 mg |
| Pota | Al2O3 | Al2O3 |
| Atmosfer | Azot | Vakum |
| Gaz akış hızı | 40 ml/dak | 0 ml/dak |
| Isıtma oranı | 5 K/dak | 5 K/dak |
Azaltılmış Basıncı Altında Termogravimetrik İncelemeler
Kaynama sürecinde olduğu gibi, gaz halindeki maddelerin açığa çıktığı diğer reaksiyonlar da benzer şekilde ortam basıncına bağlıdır. Ayrışma reaksiyonlarının sıcaklık aralıkları da azalan ortam basıncı ile daha düşük değerlere kayar. Bu sıcaklık kayması proses veya maddeye bağlı olarak değişir. Bu da negatif basınçlı atmosfer uygulamasının farklı reaksiyonlar için gaz Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma ürünlerinin salınımını farklı derecelerde etkileyebileceği anlamına gelir. Bu prosedür özellikle termal bozunma süreçleri üst üste biniyorsa, yani birbirlerine çok yakın zamansal yakınlıkta meydana geliyorlarsa faydalı olabilir. Ortam basıncının düşürülmesi daha sonra üst üste binen olayların daha iyi bir şekilde ayrılmasını sağlayabilir.
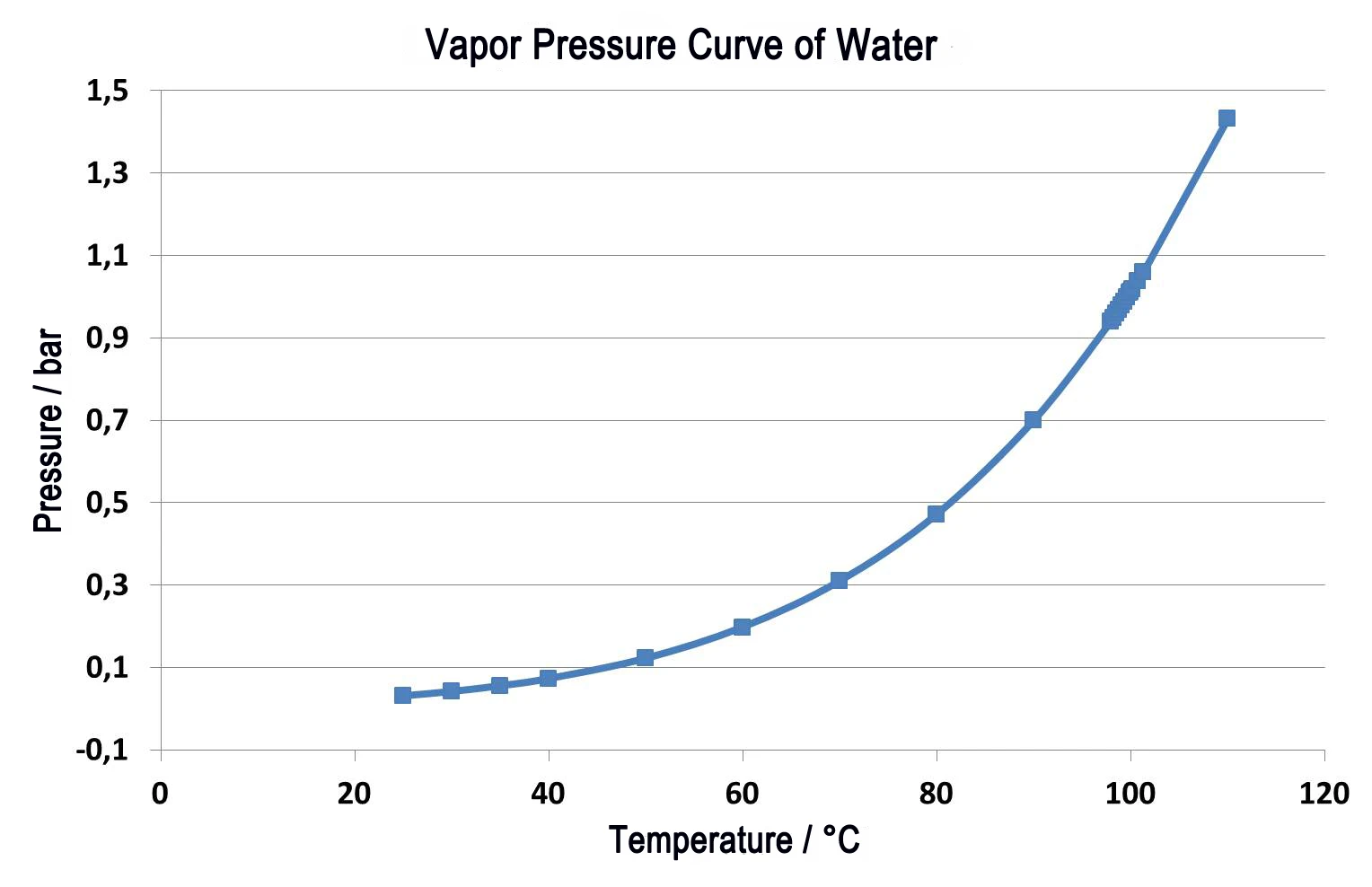
Şekil 2, termoplastik bir elastomer üzerinde yapılan iki ölçümün karşılaştırmasını göstermektedir. Düz çizgiler, sıcaklığın bir fonksiyonu olarak bağıl kütle değişimini temsil etmektedir. Yeşil eğri, azotta 40 ml/dak'lık bir boşaltma gazı hızında normal basınç altında ölçüm sonuçlarını göstermektedir. İki kütle kaybı adımı görülebilir; bunlar 5 K/dak'lık düşük ısıtma hızında bile üst üste binmektedir. Bu durumda adımların nicelleştirilmesi zordur. Bu inceleme vakumda - aynı 5 K/dak ısıtma hızında (mavi eğri) - gerçekleştirilirse, tüm salım sıcaklıkları normal basınç altındaki ölçümden daha düşük değerlere kayar. Reaksiyonun sonuna normal basınç altında 480°C'de ulaşılır, ancak vakumda reaksiyon 440°C'de tamamlanmıştır. Noktalı eğriler (DTG) her bir bağıl kütle değişimi (TG) için birinci türevi göstermektedir. DTG sonuçları kütle kaybı oranını gösterir ve bu nedenle reaksiyon hızı için bir ölçüdür. Maksimum kütle kaybı oranlarının sıcaklıkları (DTG maksimumları), her iki kısmi reaksiyonun da vakumda gerçekleşirken daha düşük sıcaklıklara kaydığını doğrulamaktadır. Ancak, ilk kısmi reaksiyon (348°C ila 212°C) ikincisinden (427°C ila 407°C) çok daha düşük sıcaklıklara kaydığı için, iki kısmi reaksiyon daha iyi ayrılır. Böylece iki kütle kaybı adımının nicelleştirilmesi önemli ölçüde kolaylaşır.