Wprowadzenie
W przypadku ogrzewania cieczy w stanie równowagi termicznej, ciśnienie pary cieczy również wzrasta wraz ze wzrostem szybkości ogrzewania. Szybkość parowania - szybkość, z jaką ciecz przechodzi w fazę gazową - rośnie wraz ze wzrostem temperatury. Szybkość utraty masy, umożliwiająca śledzenie parowania w termobalansie, wzrasta w tym samym stopniu. Termowaga może pracować pod normalnym ciśnieniem w przepływie gazu oczyszczającego, wypłukującego gazy formujące z komory próbki.
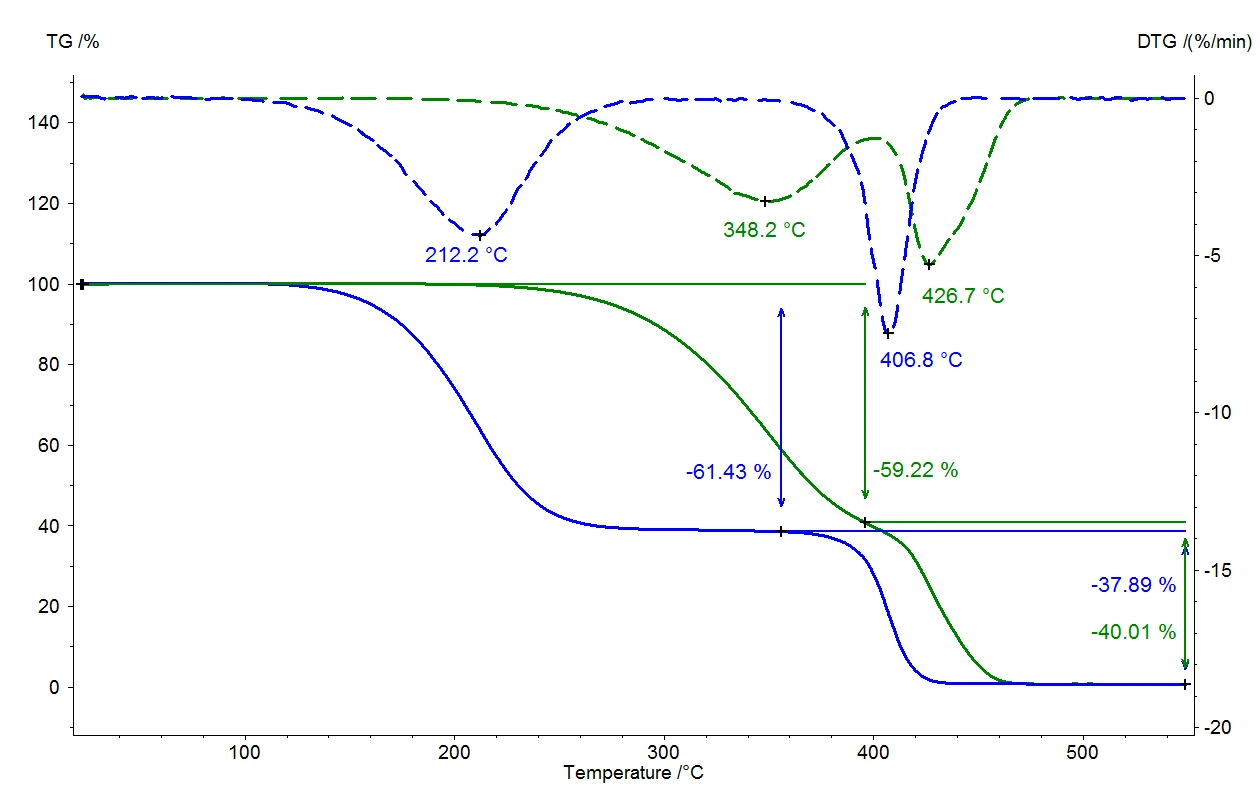
Ciecz wrze, gdy ciśnienie pary cieczy odpowiada ciśnieniu otoczenia. Pod normalnym ciśnieniem (1013 mbar) woda wrze w temperaturze 100°C, ponieważ ciśnienie pary również wynosi 1013 mbar. Jeśli ciśnienie otoczenia ulegnie zmianie, zmieni się również temperatura wrzenia. Rysunek 1 przedstawia tę korelację dla wody w zakresie temperatur od temperatury pokojowej do 110°C [1].
Jak wyraźnie widać na rysunku 1, woda wrze już w temperaturze 50°C, jeśli ciśnienie otoczenia 1013 mbar zostanie zmniejszone do 123 mbar. Zależność ta jest wykorzystywana w zastosowaniach takich jak suszenie próżniowe, w których materiał do suszenia jest wystawiony na działanie ciśnienia poniżej ciśnienia otoczenia, a ciecze (zwykle woda) mogą następnie delikatnie odparować w niskich temperaturach. Technika ta jest szczególnie często stosowana w sektorze spożywczym.
Istnieje również korelacja podobna do opisanej redukcji temperatury wrzenia dla cieczy - choć w nieco słabszej formie - dla sublimacji i rozkładu ciał stałych.
Warunki pomiaru
| Próbka | SEBS | SEBS |
|---|---|---|
| Masa | 8.635 mg | 10.130 mg |
| Tygiel | Al2O3 | Al2O3 |
| Atmosfera | Azot | Próżnia |
| Natężenie przepływu gazu | 40 ml/min | 0 ml/min |
| Szybkość ogrzewania | 5 K/min | 5 K/min |
Badania termograwimetryczne pod zmniejszonym ciśnieniem
Podobnie jak w przypadku procesu wrzenia, inne reakcje, w których uwalniane są substancje gazowe, są również podobnie zależne od ciśnienia otoczenia. Zakresy temperatur reakcji rozkładu również przesuwają się do niższych wartości wraz ze spadkiem ciśnienia otoczenia. Ta zmiana temperatury różni się w zależności od procesu lub substancji. To z kolei oznacza, że zastosowanie atmosfery podciśnieniowej może w różnym stopniu wpływać na uwalnianie gazowych produktów rozkładu dla różnych reakcji. Procedura ta może być szczególnie korzystna, jeśli procesy degradacji termicznej nakładają się na siebie; tj. jeśli występują w bardzo bliskiej odległości czasowej od siebie. Zmniejszenie ciśnienia otoczenia może wtedy spowodować lepsze oddzielenie nakładających się zdarzeń.
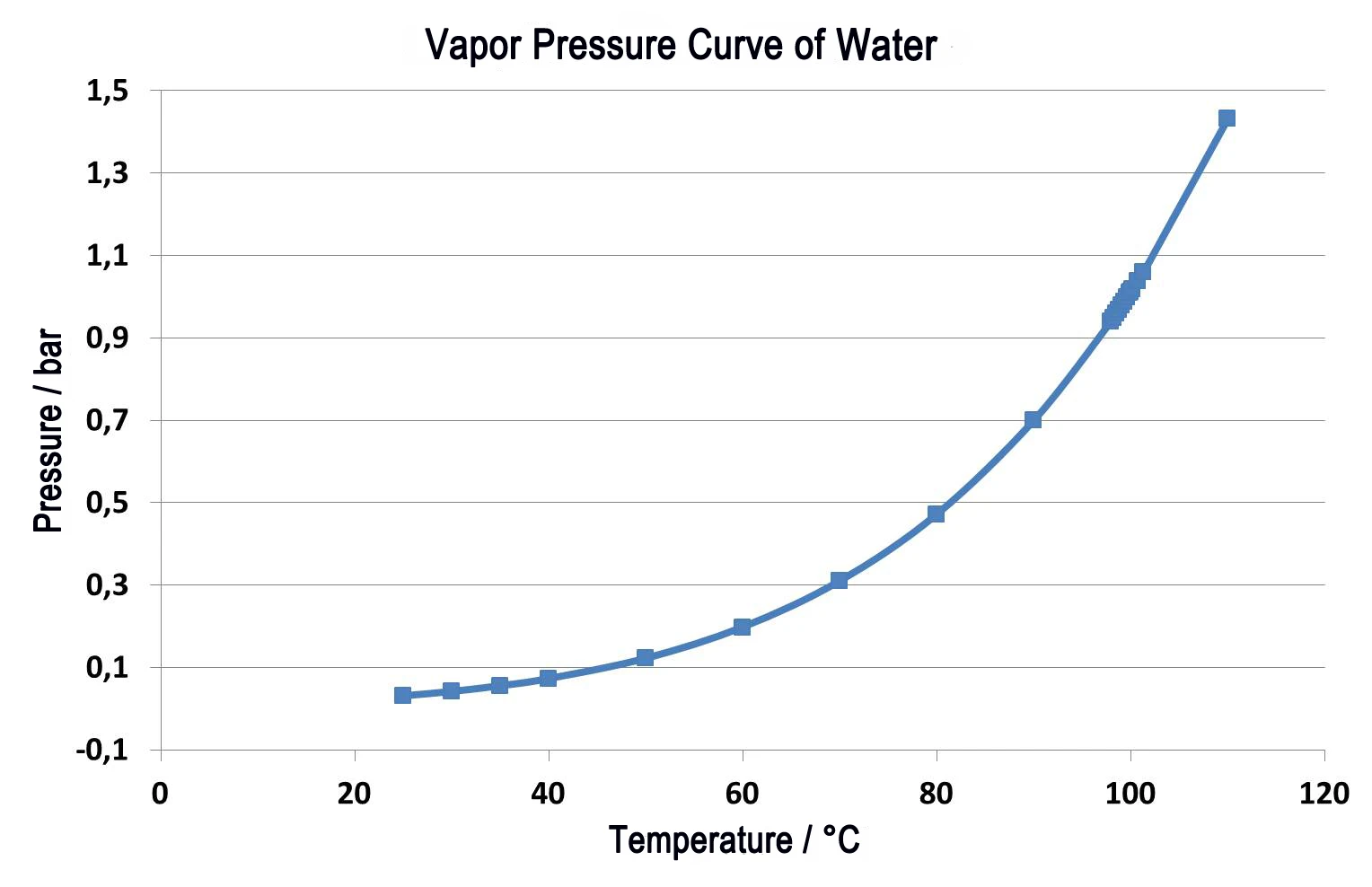
Rysunek 2 przedstawia porównanie dwóch pomiarów termoplastycznego elastomeru. Linie ciągłe przedstawiają względną zmianę masy w funkcji temperatury. Zielona krzywa przedstawia wyniki pomiarów pod normalnym ciśnieniem przy szybkości przedmuchu 40 ml/min w azocie. Widoczne są dwa etapy utraty masy; nakładają się one na siebie nawet przy niskiej szybkości ogrzewania 5 K/min. Ilościowe określenie tych etapów jest w tym przypadku trudne. Jeśli badanie to zostanie przeprowadzone w próżni - przy tej samej szybkości ogrzewania 5 K/min (niebieska krzywa) - wszystkie temperatury uwalniania są przesunięte do niższych wartości niż w pomiarze pod normalnym ciśnieniem. Koniec reakcji jest osiągany przy 480°C pod normalnym ciśnieniem, ale w próżni reakcja kończy się już przy 440°C. Kropkowane krzywe (DTG) pokazują pierwszą pochodną dla każdej względnej zmiany masy (TG). Wyniki DTG wskazują szybkość utraty masy, a zatem są miarą szybkości reakcji. Temperatury maksymalnych szybkości utraty masy (maksima DTG) potwierdzają, że obie częściowe reakcje są przesunięte do niższych temperatur, gdy zachodzą w próżni. Jednakże, ponieważ pierwsza częściowa reakcja (348°C do 212°C) jest przesunięta do znacznie niższych temperatur niż druga (427°C do 407°C), dwie częściowe reakcje są lepiej rozdzielone. Kwantyfikacja dwóch etapów utraty masy jest w ten sposób znacznie ułatwiona.