مقدمة
عند تسخين السوائل في ميزان حراري، يرتفع ضغط بخار السائل أيضًا مع زيادة معدل التسخين. ويرتفع معدل التبخر - أي معدل تحول السائل إلى الطور الغازي - مع زيادة درجات الحرارة. ويزداد معدل فقدان الكتلة، الذي يسمح بتتبع التبخر في الميزان الحراري، بنفس الدرجة. يمكن تشغيل الميزان الحراري تحت ضغط عادي في تدفق غاز التطهير الذي يطرد الغازات المتكونة خارج حجرة العينة.
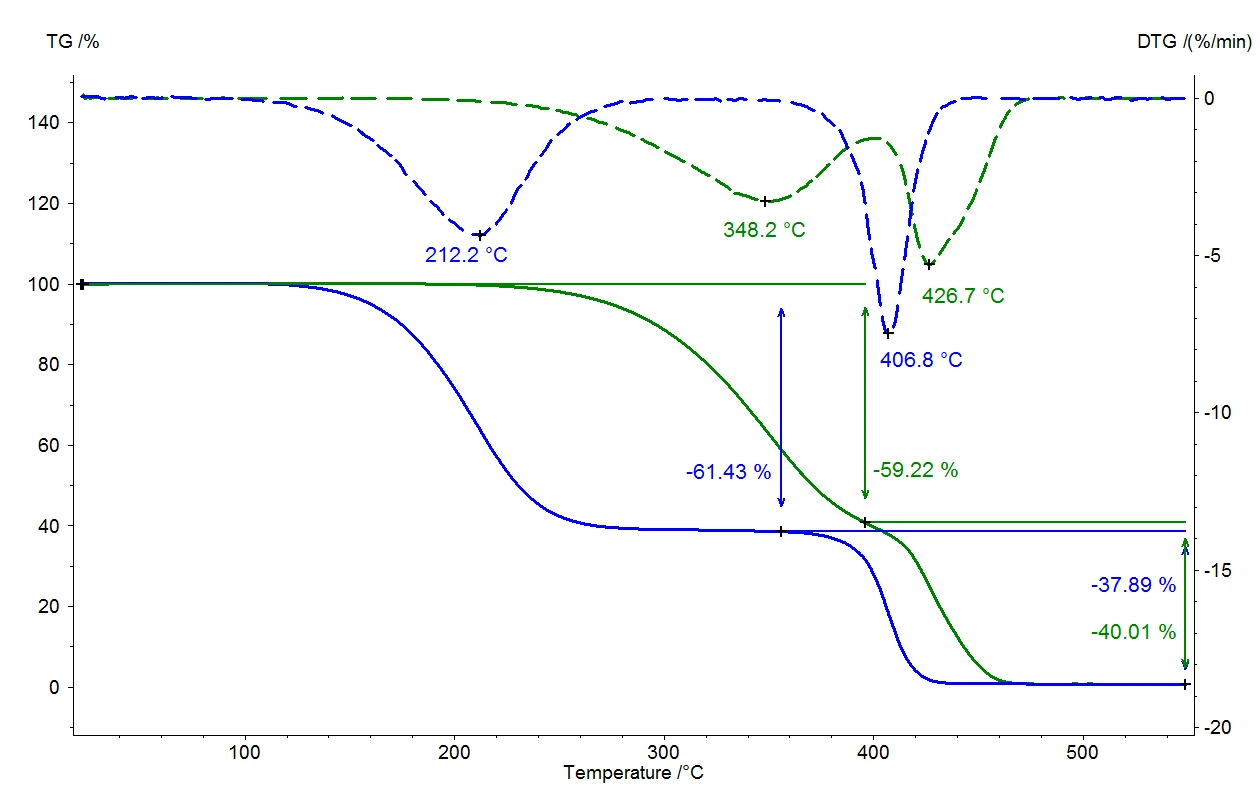
يغلي السائل عندما يتوافق ضغط بخار السائل مع الضغط المحيط. تحت الضغط العادي (1013 ملي بار)، يغلي الماء عند 100 درجة مئوية لأن ضغط البخار يبلغ أيضًا 1013 ملي بار. إذا تغير الضغط المحيط، تتغير درجة حرارة الغليان أيضًا. ويعرض الشكل 1 هذا الارتباط بالنسبة للماء في نطاق درجة الحرارة بين درجة حرارة الغرفة و110 درجات مئوية [1].
وكما يتضح من الشكل 1، يغلي الماء بالفعل عند 50 درجة مئوية إذا انخفض الضغط المحيط البالغ 1013 ملي بار إلى 123 ملي بار. يُستخدم هذا الارتباط في تطبيقات مثل التجفيف بالتفريغ، حيث يتم تعريض المادة المراد تجفيفها لضغط دون المحيط، ويمكن بعد ذلك أن تتبخر السوائل (الماء عادةً) بلطف عند درجات حرارة منخفضة. وتستخدم هذه التقنية بشكل خاص في قطاع الأغذية.
هناك أيضًا علاقة مشابهة للتخفيض الموصوف لنقطة غليان السوائل - وإن كان بشكل أضعف قليلاً - لتبخر المواد الصلبة وتحللها.
شروط القياس
| العينة | SEBS | SEBS |
|---|---|---|
| الوزن | 8.635 مجم | 10.130 مجم |
| البوتقة | Al2O3 | Al2O3 |
| الغلاف الجوي | نيتروجين | تفريغ الهواء |
| معدل تدفق الغاز | 40 مل/دقيقة | 0 مل/دقيقة |
| معدل التسخين | 5 كلفن/دقيقة | 5 كلفن/دقيقة |
تحقيقات قياس الثيرموغرافيات الحرارية تحت ضغط المخفض
وكما هو الحال مع عملية الغليان، فإن التفاعلات الأخرى التي تنطلق فيها المواد الغازية تعتمد أيضًا بالمثل على الضغط المحيط. كما تتحول نطاقات درجة حرارة تفاعلات التحلل إلى قيم أقل مع انخفاض الضغط المحيط. ويختلف هذا التحول في درجة الحرارة اعتمادًا على العملية أو المادة. وهذا بدوره يعني أن تطبيق جو الضغط السالب قد يؤثر على إطلاق نواتج التحلل الغازي للتفاعلات المختلفة بدرجات متفاوتة. يمكن أن يكون هذا الإجراء مفيدًا بشكل خاص إذا كانت عمليات التحلل الحراري متداخلة؛ أي إذا كانت تحدث في تقارب زمني قريب جدًا من بعضها البعض. ويمكن أن يؤدي خفض الضغط المحيط عندئذٍ إلى تحسين الفصل بين الأحداث المتداخلة.
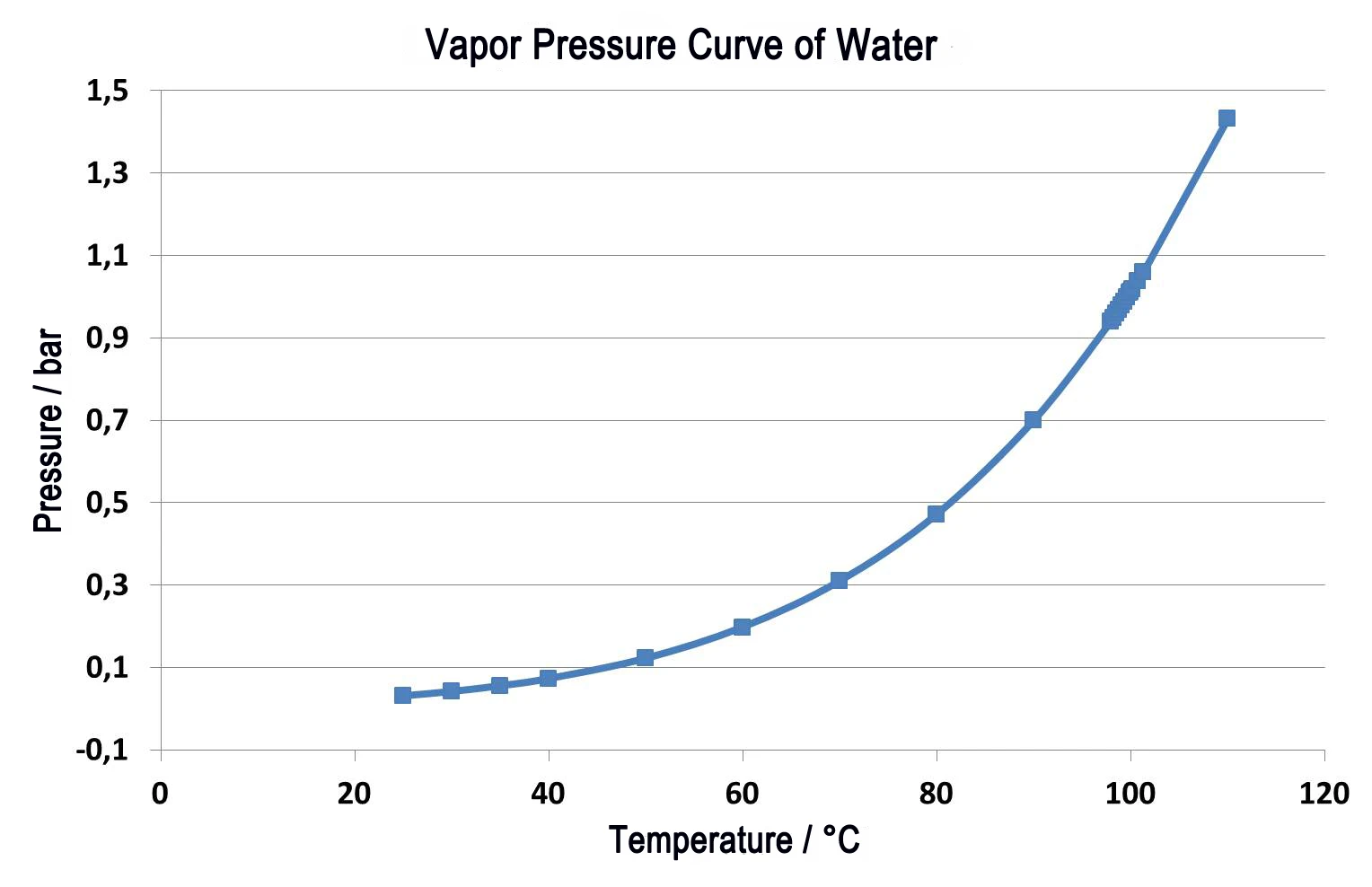
يوضح الشكل 2 مقارنة بين قياسين على لدائن لدن بالحرارة. تمثل الخطوط الصلبة التغير النسبي للكتلة كدالة لدرجة الحرارة. يصور المنحنى الأخضر نتائج القياس تحت ضغط عادي بمعدل غاز تطهير يبلغ 40 مل/دقيقة في النيتروجين. يمكن رؤية خطوتين لفقدان الكتلة، وهما متداخلتان حتى عند معدل تسخين منخفض يبلغ 5 كلفن/دقيقة. من الصعب التحديد الكمي للخطوات في هذه الحالة. إذا تم إجراء هذا الفحص في الفراغ - بنفس معدل التسخين 5 كلفن/الدقيقة (المنحنى الأزرق) - فإن جميع درجات حرارة الإطلاق تنزاح إلى قيم أقل من القياس تحت الضغط العادي. يتم الوصول إلى نهاية التفاعل عند 480 درجة مئوية تحت الضغط العادي، ولكن في الفراغ، ينتهي التفاعل بالفعل عند 440 درجة مئوية. تُظهِر المنحنيات المنقطة (DTG) المشتق الأول لكل من تغيرات الكتلة النسبية (TG). تشير نتائج DTG إلى معدل فقدان الكتلة، وبالتالي فهي مقياس لمعدل التفاعل. تؤكِّد درجات حرارة أقصى معدَّلات فقدان الكتلة (درجات الحرارة القصوى DTG) أن كلا التفاعلين الجزئيين ينتقلان إلى درجات حرارة أقل عند حدوثهما في الفراغ. ومع ذلك، بما أن التفاعل الجزئي الأول (348 درجة مئوية إلى 212 درجة مئوية) ينتقل إلى درجات حرارة أقل بكثير من درجة حرارة التفاعل الثاني (427 درجة مئوية إلى 407 درجة مئوية)، فإن التفاعلين الجزئيين منفصلين بشكل أفضل. وبالتالي يتم تسهيل التحديد الكمي لخطوتي فقدان الكتلة بشكل كبير.