Giriş
Magnezyum stearat, kozmetik ve farmasötik üretiminde yağlayıcı olarak yaygın bir şekilde kullanılmaktadır. Ticari olarak, oran olarak değişebilen çeşitli yağ asidi tuzlarının bir karışımı olarak mevcuttur. Ayrıca, magnezyum stearat monohidrat, dihidrat ve trihidrat olarak bulunabilir. Aslında, bu malzemenin fiziksel özellikleri ve özellikle yağlama özellikleri nem içeriğinden ve hidrasyon durumundan etkilenir. Bu nedenlerden dolayı, magnezyum stearatın özellikleri bir üreticiden diğerine önemli ölçüde değişebilir [2, 3].
Magnezyum stearatın değişen özellikleri, maddenin parmak izini elde etmek için özellikle kolay ve hızlı bir yöntem olan DSC aracılığıyla araştırılabilir. Bir başka termal analiz yöntemi olan TGA, magnezyum stearatın hidrasyon durumu hakkında bir gösterge vermeye yardımcı olabilir.
Aşağıda, bir magnezyum stearat numunesi DSC ve TGA ölçümleri ile karakterize edilmiştir. Buna ek olarak, kuru azot atmosferinde 60°C ve 120°C'de 2 saatlik depolama süresinin termal özellikler üzerindeki etkisi incelenmiştir.
Test Koşulları
Ölçümler DSC 214 Polyma ve TG 209 Libra® ile dinamik azot atmosferinde gerçekleştirilmiştir. Delikli kapaklı sızdırmaz Concavus® krozeler kullanılmıştır.
Test Sonuçları
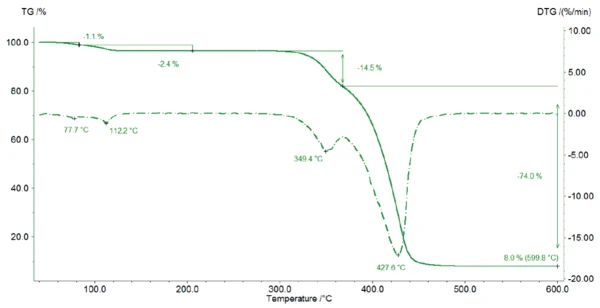
Şekil 2'de magnezyum stearatın TGA eğrisi gösterilmektedir. Oda sıcaklığı ile 125°C arasında numune, su salınımından kaynaklanan ilk kütlesinin %3,5'ini kaybeder. Bu sıcaklık aralığında, DTG eğrisinde (TGA eğrisinin1. türevi) iki adımı gösteren iki pik tespit edilir: ilk olarak yüzey suyu buharlaşır (1. kütle kaybı adımı %1,1), ardından hidrat suyu serbest kalır (2. kütle kaybı adımı %2,4) Magnezyum stearat için 591,27 g/mol'lük bir molar kütle, monohidrat formu için %2,95, dihidrat formu için %5,74 ve trihidrat formu için %8,37'lik bir teorik su kaybına neden olur. Bu nedenle, tespit edilen kütle kaybı magnezyum stearatın monohidrat formunun bir göstergesidir: Isıtma sırasında numune önce yüzey suyunu kaybeder (1. kütle kaybı adımı %1,1), ardından kristal suyu açığa çıkar.
Bu sonuç, D. Lugge tarafından [4]'te açıklanan TGA eğrileri ile doğrulanabilir: Saf magnezyum stearat dihidrat ve saf trihidrat için kütle kaybı daha düşük bir sıcaklıkta olacaktır.
Bu nedenle, ölçülen numune en azından magnezyum stearatın monohidrat formunu içermektedir. Oda sıcaklığı ile 125°C arasında %2,95'lik teorik su kaybı ile %3,5'lik ölçülen su kaybı arasındaki fark, yüzey suyunun buharlaşmasından ve/veya numunedeki dihidrat/trihidrat varlığından kaynaklanıyor olabilir.
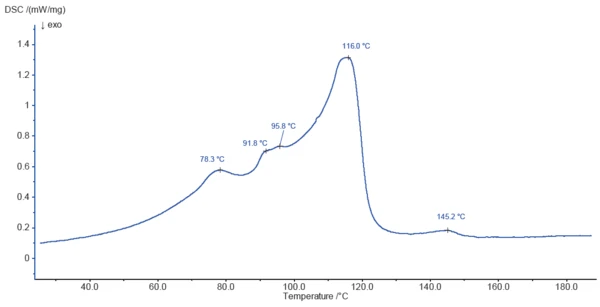
Şekil 3, 200°C'ye ısıtma sırasında magnezyum stearatın DSC eğrisini göstermektedir. 78,3°C, 91,8°C, 95,8°C ve 116,0°C'de tespit edilen pikler, TGA tarafından belirtildiği gibi kısmen yüzey suyunun ve bağlı suyun salınmasından kaynaklanmaktadır. BuharlaşmaBir elementin veya bileşiğin buharlaşması, sıvı fazdan buhara bir faz geçişidir. İki tür buharlaşma vardır: buharlaşma ve kaynama.Buharlaşma süreci muhtemelen numune bileşenlerinin erimesi ile örtüşmektedir.
145,2°C'deki endotermal etki kütle kaybıyla ilişkili değildir ve muhtemelen numunenin bir bileşeninin erimesinden kaynaklanmaktadır.
Şekil 4, magnezyum stearatın alındığı haliyle DSC eğrilerini ve sırasıyla 60°C'de (kırmızı eğri) ve 120°C'de (siyah eğri) 2 saat depolandıktan sonra malzemenin DSC eğrilerini göstermektedir.
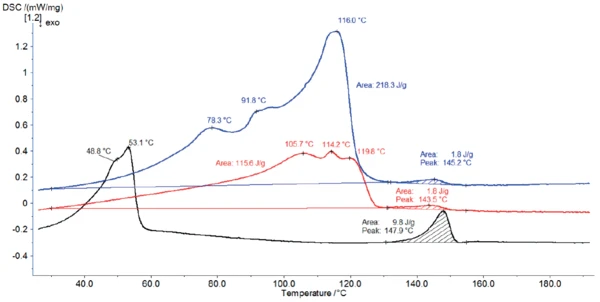
120°C'de depolama (siyah eğri) DSC profilini tamamen değiştirmiştir: Hidrat suyunu uzaklaştırmıştır. Ertel ve Carstensens'e [5] göre, 105°C'de ısıtma sadece suyu uzaklaştırmakla kalmaz, aynı zamanda kristallerin yapısını da değiştirir. Burada, 120°C'de depolama 49°C ve 53°C'de pik sıcaklıklara sahip bir yapı ortaya çıkarmıştır.
60°C'de depolama sırasında numune suyunun bir kısmını kaybeder. Bu nedenle, DSC'de ısıtma sırasında açığa çıkan su miktarı azalır ve 30°C ile 130°C arasındaki tepe entalpisini düşürür. Ek olarak, etkiler hafifçe daha yüksek sıcaklıklara kayar.
130°C ile 155°C arasındaki pik her üç ölçüm için de tespit edilmiştir ve farmasötik sınıf magnezyum stearatın teorikErime Sıcaklıkları ve EntalpileriGizli ısı olarak da bilinen bir maddenin füzyon entalpisi, bir maddeyi katı halden sıvı hale dönüştürmek için gerekli olan enerji girdisinin, tipik olarak ısının bir ölçüsüdür. Bir maddenin erime noktası, katı (kristal) halden sıvı (izotropik eriyik) hale geçtiği sıcaklıktır. erime aralığı (130°C ile 145°C [6]) ile oldukça iyi bir uyum içindedir. Bununla birlikte, 120°C'de depolanan numune için entalpisi çok daha yüksektir. Yukarıda belirtildiği gibi, 120°C'de depolamadan sonra bu yüksek tepe entalpisi muhtemelen magnezyum stearatın yapısındaki bir değişiklikle ilişkilidir [5].
Sonuç
Magnezyum stearatın farklı sıcaklıklarda depolanması, DSC eğrilerinin değişiminde görülebilen farklı termal davranışlar ortaya çıkarır. Isıl işlem farklı şekilde bağlanmış suyun salınmasına neden olur, su salınım sıcaklığı suyun türünü (örn. yüzey suyu) gösterir. DSC eğrilerindeki farklılıklar muhtemelen depolama sırasında numunenin kristal yapısındaki değişikliklerden de kaynaklanmaktadır.
Piyasada bulunan magnezyum stearatlar, bir üreticiden diğerine değişebilen farklı yağ asitlerinin karışımlarıdır, bu da TGA ve DSC'yi farmasötik bir bileşim hazırlamadan önce doğrulama için vazgeçilmez araçlar haline getirir.