Introduzione
Lo stearato di magnesio è ampiamente utilizzato come lubrificante nella produzione di cosmetici e prodotti farmaceutici. È disponibile in commercio come miscela di diversi sali di acidi grassi che possono variare in proporzione. Inoltre, lo stearato di magnesio può essere trovato come monoidrato, diidrato e triidrato. Le proprietà fisiche e, in particolare, le proprietà lubrificanti di questo materiale sono influenzate dal suo contenuto di umidità e dal suo stato di idratazione. Per questi motivi, le proprietà dello stearato di magnesio possono variare notevolmente da un produttore all'altro [2, 3].
Le diverse proprietà dello stearato di magnesio possono essere studiate mediante DSC, un metodo particolarmente semplice e veloce per ottenere un'impronta digitale della sostanza. Un altro metodo di analisi termica, la TGA, può contribuire a dare un'indicazione sullo stato di idratazione dello stearato di magnesio.
Di seguito, un campione di stearato di magnesio è stato caratterizzato mediante misure DSC e TGA. Inoltre, è stata studiata l'influenza sulle proprietà termiche di un periodo di stoccaggio di 2 ore a 60°C e 120°C in atmosfera di azoto secco.
Condizioni di prova
Le misure sono state effettuate con un DSC 214 Polyma e un TG 209 Libra® in atmosfera dinamica di azoto. Sono stati utilizzati crogioli sigillati Concavus® con coperchio forato.
Risultati del test
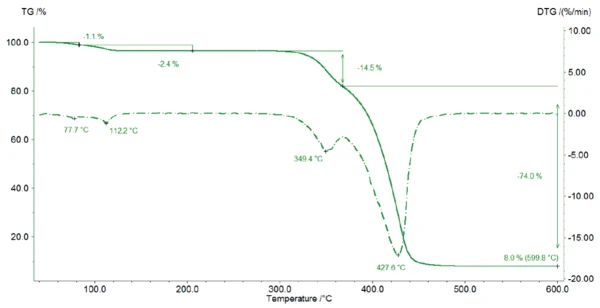
La Figura 2 mostra la curva TGA dello stearato di magnesio. Tra la temperatura ambiente e i 125°C, il campione perde il 3,5% della sua massa iniziale, a causa del rilascio di acqua. In questo intervallo di temperatura, si rilevano due picchi nella curva DTG (1a derivata della curva TGA) che indicano due fasi: prima evapora l'acqua di superficie (1a fase di perdita di massa 1,1%), poi viene rilasciata l'acqua dell'idrato (2a fase di perdita di massa 2,4%). Pertanto, la perdita di massa rilevata è un'indicazione per la forma monoidrata dello stearato di magnesio: Durante il riscaldamento, il campione perde innanzitutto l'acqua superficiale (1a fase di perdita di massa 1,1.%) prima che venga rilasciata l'acqua cristallina.
Questo risultato può essere confermato dalle curve TGA descritte da D. Lugge in [4]: Per uno stearato di magnesio diidrato e triidrato puro, la perdita di massa avverrebbe a una temperatura inferiore.
Pertanto, il campione misurato contiene almeno la forma monoidrata di magnesio stearato. La differenza tra la perdita teorica di acqua del 2,95% e quella misurata del 3,5% tra la temperatura ambiente e 125°C può derivare dall'evaporazione dell'acqua superficiale e/o dalla presenza di diidrato/triidrato nel campione.
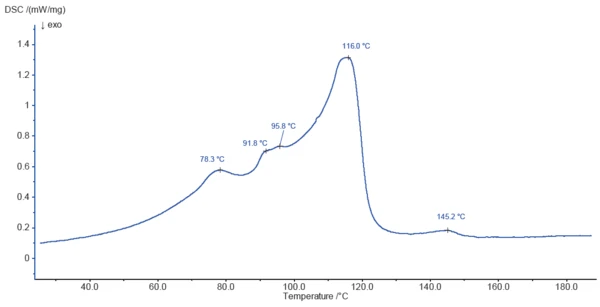
La figura 3 mostra la curva DSC dello stearato di magnesio durante il riscaldamento a 200°C. I picchi rilevati a 78,3°C, 91,8°C, 95,8°C e 116,0°C sono in parte dovuti al rilascio di acqua superficiale e acqua legata, come indicato dalla TGA. Il processo di evaporazione è probabilmente sovrapposto allaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione dei componenti del campione.
L'effetto EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico a 145,2°C non è associato a una perdita di massa ed è probabilmente dovuto allaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione di un componente del campione.
La Figura 4 mostra le curve DSC dello stearato di magnesio come ricevuto e le curve DSC del materiale dopo lo stoccaggio per 2 ore rispettivamente a 60°C (curva rossa) e a 120°C (curva nera).
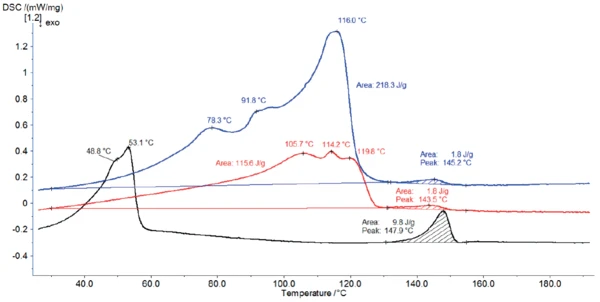
La conservazione a 120°C (curva nera) ha cambiato completamente il profilo DSC: Ha rimosso l'acqua idrata. Secondo Ertel e Carstensens [5], il riscaldamento a 105°C non solo rimuove l'acqua, ma modifica anche la struttura dei cristalli. In questo caso, la conservazione a 120°C ha prodotto una struttura con picchi di temperatura a 49°C e 53°C.
Durante la conservazione a 60°C, il campione perde parte dell'acqua. Pertanto, la quantità di acqua rilasciata durante il riscaldamento nel DSC diminuisce, abbassando l'entalpia di picco tra 30°C e 130°C. Inoltre, gli effetti sono leggermente spostati verso temperature più elevate.
Il picco tra 130°C e 155°C viene rilevato per tutte e tre le misurazioni ed è in buon accordo con l'intervallo diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione teorico dello stearato di magnesio di grado farmaceutico (da 130°C a 145°C [6]). Tuttavia, l'entalpia del picco è molto più alta per il campione conservato a 120°C. Come già detto, questa maggiore entalpia del picco è stata rilevata in tutte e tre le misure. Come già detto, questo picco di entalpia più elevato dopo la conservazione a 120°C è probabilmente associato a un cambiamento nella struttura dello stearato di magnesio [5].
Conclusione
L'immagazzinamento dello stearato di magnesio a diverse temperature produce un comportamento termico diverso, che può essere osservato nella variazione delle curve DSC. Il trattamento termico provoca il rilascio di acqua legata in modo diverso; la temperatura di rilascio dell'acqua fornisce un'indicazione del tipo di acqua (ad esempio, acqua superficiale). Le differenze nelle curve DSC probabilmente derivano anche da cambiamenti nella struttura cristallina del campione durante lo stoccaggio.
Gli stearati di magnesio disponibili in commercio sono miscele di diversi acidi grassi che possono variare da un produttore all'altro, rendendo TGA e DSC strumenti indispensabili per la verifica prima della preparazione di una composizione farmaceutica.