Einführung
Magnesiumstearat wird häufig als Schmiermittel bei der Herstellung von Kosmetika und Pharmazeutika eingesetzt. Es ist kommerziell als eine Mischung aus verschiedenen, im Verhältnis zueinander variierenden Fettsäuresalzen erhältlich und kann zusätzlich als Mono-, Di- und Trihydrat vorliegen. Die physikalischen Eigenschaften von Magnesiumstearat – insbesondere die Schmierfähigkeit – werden durch den Feuchtegehalt und den Hydradationsgrad beeinflusst, weshalb die Eigenschaften dieser Substanz von Hersteller zu Hersteller beträchtlich variieren können [2, 3].
Die Unterschiede in den Eigenschaften von Magnesiumstearat können mittels DSC untersucht werden, die eine schnelle und einfache Methode zum Erhalt eines Fingerabdruckes von der Substanz darstellt. Als weitere thermoanalytische Methode gibt die Thermogravimetrie (TG) Aufschlüsse über die Hydratation von Magnesiumstearat.
Hier wurde eine Magnesiumstearat-Probe mittels DSCund TG-Messungen charakterisiert. Zusätzlich wurde der Einfluss einer 2-stündigen Lagerung bei 60 °C und 120 °C in trockener Stickstoffatmosphäre auf die thermischen Eigenschaften untersucht.
Messbedingungen
Die Messungen wurden mit der DSC 214 Polyma und der TG 209 Libra® in dynamicher Stickstoffatmosphäre durchgeführt. Es wurden Concavus®-Tiegel mit gelochtem Deckel verwendet.
Messergebnisse
Zwischen Raumtemperatur und 125 °C verliert die Probe während der TG-Messung 3,5 % ihrer Ausgangsmasse, was auf die Freisetzung von Wasser zurückzuführen ist (Abbildung 2). Die zwei Peaks in der DTG-Kurve (1. Ableitung der TG-Kurve) in diesem Temperaturbereich weisen auf zwei Stufen hin: zunächst verdampft das Oberflächenwasser (1. Massenverluststufe 1,1%) dann das Hydratwasser (2. Massenverluststufe 2,4%). Die Molmasse von Magnesiumstearat beträgt 591,27 g/mol. Das bedeutet, es resultiert ein theoretischer Wasserverlust von 2,95% für die Monohydratform, ein Massenverlust von 5,74 % für das Dihydrat und 8,73 % für das Trihydrat. Aus diesem Grund ist der detektierte Massenverlust von 2.4% ein Anzeichen für die Monohydratform von Magnesiumstearat.
Dies kann durch die von D. Lugge in [4] beschriebenen TG-Kurven bestätigt werden: Für reines Magnesiumstearat-Dihydrat und -trihydrat würde das Kristallwasser bei niedrigeren Temperaturen auftreten.
Somit enthält die gemessene Probe mindestens die Monohydratform von Magnesiumstearat. Der Unterschied zwischen dem theoretischen Wasserverlust von 2,95 % und dem gemessenen Wasserverlust von 3,5 % zwischen Raumtemperatur und 125 °C kann eine Folge der Freisetzung von Oberfl ächenwasser und/oder dem Vorhandensein des Dihydrats und/oder Trihydrats im Probenkörper sein.
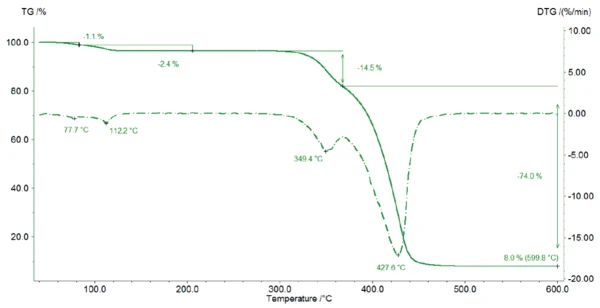
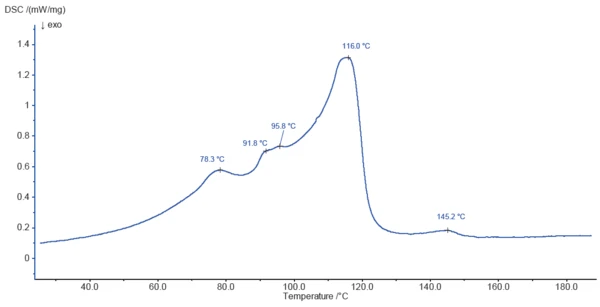
Abbildung 3 zeigt die DSC-Kurve an Magnesiumstearat während der Aufheizung bis 200 °C. Die bei 78 °C, 92 °C, 96 °C und 116 °C detektierten Peaks sind teilweise auf die Freisetzung von Oberflächenwasser und gebundenem Wasser – wie mittels TG bereits aufgezeigt – zurückzuführen. Der Prozess der Wasserfreisetzung ist vermutlich vom Schmelzen von Probenkomponenten überlagert. Der endotherme Effekt bei 145 °C ist nicht mit einem Massenverlust verbunden und wahrscheinlich auf das Schmelzen eines Bestandteils der Probe zurückzuführen.
In Abbildung 4 sind die DSC-Kurven von Magnesiumstearat im Anlieferungszustand zusammen mit den DSC-Kurven des Materials nach zweistündiger Lagerung bei 60 °C (rote Kurve) bzw. 120 °C (schwarze Kurve) widergegeben.
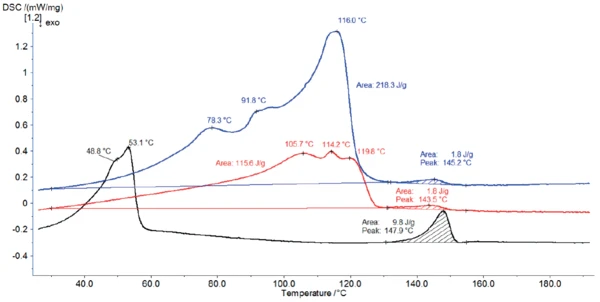
Die Lagerung bei 120 °C (schwarze Kurve) hat das DSC-Kurvenprofil durch die Freisetzung des Hydratationswasser vollständig verändert. Nach Ertel und Carstensens [5] entfernt das Erhitzen bei 105 °C nicht nur Wasser, sondern verändert auch die Kristallstruktur. Hier führt die Lagerung bei 120 °C zu einer Struktur mit Peaktemperaturen bei 49 °C und 53 °C.
Während der Lagerung bei 60 °C verliert die Probe nur einen Teil ihres Wassers. Deshalb verringert sich der während der Aufheizung freigesetzte Wasseranteil in der DSC, was die Peakenthalpie zwischen 30 °C und 130 °C erniedrigt. Zusätzlich sind die Effekte zu leicht höheren Temperaturen verschoben.
Der Peak zwischen 130 °C und 155 °C wurde bei allen drei Messungen detektiert und stimmt gut mit dem theoretischen Schmelzbereich für Magnesiumstearat in pharmazeutischer Qualität (130 °C bis 145 °C [6]) überein. Seine Enthalpie ist jedoch bei der bei 120 °C gelagerten Probe am höchsten. Wie bereits erwähnt, ist diese höhere Peakenthalpie nach Lagerung bei 120 °C wahrscheinlich mit einer Änderung der Magnesiumstearat- Struktur verbunden [5].
Zusammenfassung
Die Lagerung von Magnesiumstearat bei verschiedenen Temperaturen verursacht ein unterschiedliches thermisches Verhalten, das durch die Änderungen der DSC-Kurven bestätigt wird. Die thermische Behandlung bedingt die Freisetzung von unterschiedlich gebundenem Wasser und liefert Hinweise auf den Wassertyp (z.B. Oberflächenwasser). Die Unterschiede in den DSC-Kurven sind auch auf Änderungen in der Kristallstruktur der Probe während der Lagerung zurückzuführen [5].
Handelsübliche Magnesiumstearate sind Mischungen aus unterschiedlichen Fettsäuren, die von Hersteller zu Hersteller variieren können, was TG und DSC zu unverzichtbaren Werkzeugen für die Überprüfung vor der Herstellung einer pharmazeutischen Formulierung.