Wprowadzenie
Stearynian magnezu jest szeroko stosowany jako środek smarny w produkcji kosmetyków i farmaceutyków. Jest on dostępny w handlu jako mieszanina kilku soli kwasów tłuszczowych, których proporcje mogą się różnić. Ponadto stearynian magnezu można znaleźć w postaci monohydratu, dihydratu i trihydratu. W rzeczywistości na właściwości fizyczne, a zwłaszcza właściwości smarne tego materiału, wpływa jego zawartość wilgoci i stan uwodnienia. Z tych powodów właściwości stearynianu magnezu mogą się znacznie różnić w zależności od producenta [2, 3].
Zmienne właściwości stearynianu magnezu można badać za pomocą DSC, która jest szczególnie łatwą i szybką metodą uzyskiwania odcisku palca substancji. Inna metoda analizy termicznej, TGA, może pomóc wskazać stan uwodnienia stearynianu magnezu.
Poniżej scharakteryzowano próbkę stearynianu magnezu za pomocą pomiarów DSC i TGA. Ponadto zbadano wpływ 2-godzinnego okresu przechowywania w temperaturze 60°C i 120°C w atmosferze suchego azotu na właściwości termiczne.
Warunki testu
Pomiary przeprowadzono za pomocą DSC 214 Polyma i TG 209 Libra® w dynamicznej atmosferze azotu. Zastosowano uszczelnione tygle Concavus® z przebitą pokrywą.
Wyniki testów
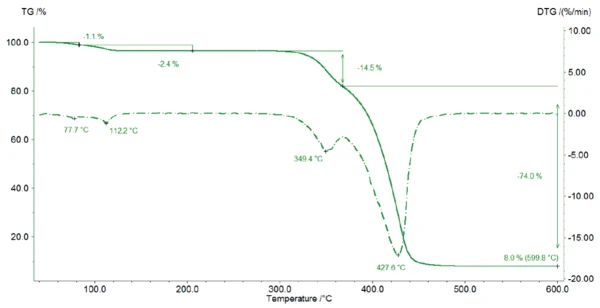
Rysunek 2 przedstawia krzywą TGA stearynianu magnezu. Pomiędzy temperaturą pokojową a 125°C próbka traci 3,5% swojej początkowej masy, co wynika z uwalniania wody. W tym zakresie temperatur na krzywej DTG (1. pochodna krzywej TGA) wykrywane są dwa piki wskazujące na dwa etapy: najpierw odparowuje woda powierzchniowa (1. etap utraty masy 1,1%), a następnie uwalniana jest woda hydratowa (2. etap utraty masy 2,4%). Masa molowa stearynianu magnezu wynosząca 591,27 g/mol skutkuje teoretyczną utratą wody wynoszącą 2,95% dla postaci monohydratu, 5,74% dla postaci dihydratu i 8,37% dla postaci trihydratu. Dlatego wykryta utrata masy jest wskazaniem dla postaci monohydratu stearynianu magnezu: Podczas ogrzewania próbka najpierw traci wodę powierzchniową (1. stopień ubytku masy 1,1%), zanim uwolniona zostanie woda krystaliczna.
Wynik ten można potwierdzić za pomocą krzywych TGA opisanych przez D. Lugge w [4]: W przypadku czystego dwuwodnego stearynianu magnezu i czystego trójwodnego stearynianu magnezu utrata masy nastąpiłaby w niższej temperaturze.
Dlatego zmierzona próbka zawiera co najmniej monohydrat stearynianu magnezu. Różnica między teoretyczną utratą wody wynoszącą 2,95% a zmierzoną wynoszącą 3,5% między temperaturą pokojową a 125°C może wynikać z odparowania wody powierzchniowej i/lub z obecności dihydratu/trihydratu w próbce.
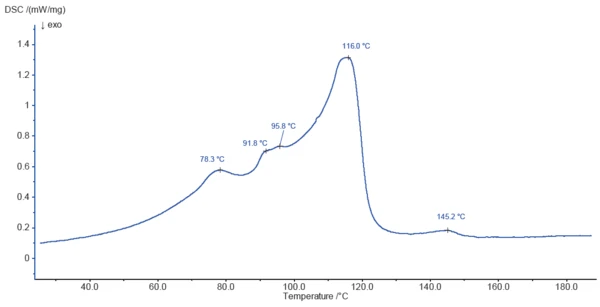
Rysunek 3 przedstawia krzywą DSC stearynianu magnezu podczas ogrzewania do 200°C. Piki wykryte przy 78,3°C, 91,8°C, 95,8°C i 116,0°C są częściowo spowodowane uwalnianiem wody powierzchniowej i wody związanej, jak wskazano w TGA. Proces parowania prawdopodobnie nakłada się naTemperatury i entalpie topnieniaEntalpia syntezy substancji, znana również jako ciepło utajone, jest miarą nakładu energii, zazwyczaj ciepła, która jest niezbędna do przekształcenia substancji ze stanu stałego w ciekły. Temperatura topnienia substancji to temperatura, w której zmienia ona stan ze stałego (krystalicznego) na ciekły (stopiony izotropowo). topnienie składników próbki.
Efekt EndotermicznyPrzemiana próbki lub reakcja jest endotermiczna, jeśli do konwersji potrzebne jest ciepło.endotermiczny w temperaturze 145,2°C nie jest związany z utratą masy i jest prawdopodobnie spowodowany topnieniem składnika próbki.
Rysunek 4 przedstawia krzywe DSC stearynianu magnezu po otrzymaniu wraz z krzywymi DSC materiału po przechowywaniu przez 2 godziny odpowiednio w temperaturze 60°C (krzywa czerwona) i 120°C (krzywa czarna).
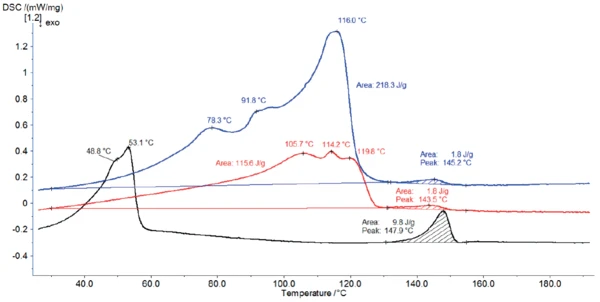
Przechowywanie w temperaturze 120°C (czarna krzywa) całkowicie zmieniło profil DSC: Usunięto wodę hydratacyjną. Według Ertel i Carstensens [5], ogrzewanie w temperaturze 105°C nie tylko usuwa wodę, ale także zmienia strukturę kryształów. W tym przypadku przechowywanie w temperaturze 120°C dało strukturę o szczytowych temperaturach 49°C i 53°C.
Podczas przechowywania w temperaturze 60°C próbka traci część wody. Dlatego ilość wody uwalnianej podczas ogrzewania w DSC zmniejsza się, obniżając szczytową entalpię między 30°C a 130°C. Dodatkowo, efekty są nieznacznie przesunięte w kierunku wyższych temperatur.
Pik między 130°C a 155°C jest wykrywany dla wszystkich trzech pomiarów i jest w dość dobrej zgodności z teoretycznym zakresem topnienia stearynianu magnezu klasy farmaceutycznej (130°C do 145°C [6]). Jednak jego entalpia jest znacznie wyższa dla próbki przechowywanej w temperaturze 120°C. Jak wspomniano powyżej, ta wyższa szczytowa entalpia po przechowywaniu w temperaturze 120°C jest prawdopodobnie związana ze zmianą struktury stearynianu magnezu [5].
Wnioski
Przechowywanie stearynianu magnezu w różnych temperaturach daje różne zachowanie termiczne, co można zaobserwować w zmianach krzywych DSC. Obróbka termiczna powoduje uwalnianie różnie związanej wody, a temperatura uwalniania wody wskazuje na rodzaj wody (np. woda powierzchniowa). Różnice w krzywych DSC prawdopodobnie wynikają również ze zmian w strukturze krystalicznej próbki podczas przechowywania.
Dostępne na rynku stearyniany magnezu są mieszaninami różnych kwasów tłuszczowych, które mogą się różnić w zależności od producenta, co sprawia, że TGA i DSC są niezbędnymi narzędziami do weryfikacji przed przygotowaniem kompozycji farmaceutycznej.