
05.08.2020 by Dr. Gabriele Kaiser
Identificazione chiara delle materie prime (RMID) mediante DSC
L'identificazione delle materie prime o l'ispezione delle merci in entrata è di fondamentale importanza per la qualità e la sicurezza dei prodotti farmaceutici, ovunque le sostanze chimiche vengano utilizzate nell'industria farmaceutica, sia come prodotto di reazioni chimiche che come base per ulteriori lavorazioni.
Le grandezze caratteristiche che si prestano ad essere utilizzate per l'identificazione della sostanza sono
- Temperatura diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione/transizione
- Entalpia diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione (calore diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione)
- Entalpia di transizione
- Temperatura di transizione vetrosa
- Capacità termica specifica
Tutti questi valori possono essere determinati con la calorimetria a scansione differenziale (DSC). La temperatura di fusione e l'entalpia di fusione sono tipiche delle sostanze cristalline, compresi i polimorfi; la temperatura di transizione vetrosa è un attributo dei materiali amorfi. Le sostanze semicristalline presentano sia effetti diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione che di transizione vetrosa.
Dati caratteristici della fenacetina
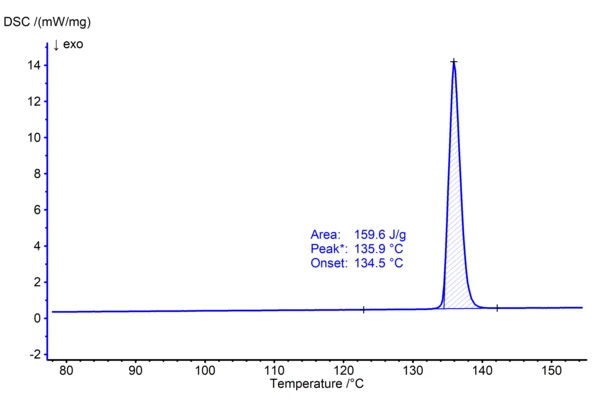
La fenacetina è stata introdotta nel 1887 come analgesico, ma a causa del suo effetto dannoso, soprattutto a livello renale, in combinazione con altri farmaci antidolorifici, questo prodotto farmaceutico non è più disponibile sul mercato nella maggior parte dei Paesi. La fenacetina pura, tuttavia, fa parte del set di purezza per l'analisi termica del NIST (National Institutes of Standards and Technology, SRM 1514) ed è quindi adatta a illustrare la determinazione del Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione. Nell'esperimento che segue, 1,04 mg di fenacetina sono stati riscaldati in atmosfera di azoto in crogioli di alluminio a una velocità di riscaldamento di 10 K/min fino a 160°C. La curva DSC (fig. 1), ottenuta da questa misurazione, mostra un effetto EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico che rappresenta laTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione della sostanza. Il capitolo USP <891> raccomanda di correlare la temperatura di insorgenza estrapolata dell'effetto DSC (nel caso in questione a 134,5°C) al Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione del materiale cristallino. Il termine è temperatura di insorgenza della fusione. L'entalpia di fusione corrispondente (o calore di fusione) viene calcolata mediante l'integrazione dei picchi, ottenendo 159,6 J/g. La valutazione può essere eseguita automaticamente utilizzando le AutoEvaluation funzionalità del softwareNETZSCH Proteus® . Entrambi i risultati concordano bene con i valori riportati in letteratura (1) e (2).
Letteratura: (1) H. Manzo, A.A. Ahumada,, J. Pharm. Sci., 1990, 79, 12, pp 1109 - 1115 (407,2 K) (2) A. Pen͂a, B. Excalera, A. Reillo, A.B. Sánchez, P. Bustamante, J. Pharm. Sci., 2009, 98, 3, pp 1129 - 1135 (28,75 kJ/mol, sulla base di una massa molare di 179,21 g/mol).