
05.08.2020 by Dr. Gabriele Kaiser
Clear Raw Material Identification (RMID) Using DSC
Raw material identification or incoming goods inspection is of paramount importance for the quality and safety of drug products, wherever chemical substances are used in the pharmaceutical industry – maybe as an educt of chemical reactions or as a basis for further processing.
Characteristic quantities which are suitable for being used for substance identification are
- Melting Temperatures and EnthalpiesThe enthalpy of fusion of a substance, also known as latent heat, is a measure of the energy input, typically heat, which is necessary to convert a substance from solid to liquid state. The melting point of a substance is the temperature at which it changes state from solid (crystalline) to liquid (isotropic melt).Melting/transition temperature
- Melting Temperatures and EnthalpiesThe enthalpy of fusion of a substance, also known as latent heat, is a measure of the energy input, typically heat, which is necessary to convert a substance from solid to liquid state. The melting point of a substance is the temperature at which it changes state from solid (crystalline) to liquid (isotropic melt).Melting enthalpy (heat of fusion)
- Transition enthalpy
- Glass transition temperature
- Specific heat capacity
All of them can be determined by means of differential scanning calorimetry (DSC). The melting temperature and melting enthalpy are typical for crystalline substances including polymorphs; the glass transition temperature is an attribute of amorphous materials. Semi-crystalline substances exhibit both melting and Temperatura de Transición VítreaThe glass transition is one of the most important properties of amorphous and semi-crystalline materials, e.g., inorganic glasses, amorphous metals, polymers, pharmaceuticals and food ingredients, etc., and describes the temperature region where the mechanical properties of the materials change from hard and brittle to more soft, deformable or rubbery.glass transition effects.
Characteristic Data of Phenacetin
Phenacetin was introduced in 1887 as an analgesic, but because of its harmful, especially kidney-damaging effect in combination with other pain medication, this pharmaceutical is for most countries no longer available on the market as a drug product. Pure phenacetin is, however, part of the thermal analysis purity set from NIST (National Institutes of Standards and Technology, SRM 1514) and therefore well suitable for illustrating the Melting Temperatures and EnthalpiesThe enthalpy of fusion of a substance, also known as latent heat, is a measure of the energy input, typically heat, which is necessary to convert a substance from solid to liquid state. The melting point of a substance is the temperature at which it changes state from solid (crystalline) to liquid (isotropic melt).melting point determination. In the following experiment, 1.04 mg of phenacetin was heated in a nitrogen atmosphere in aluminum crucibles at a heating rate of 10 K/min to 160°C. The DSC curve (fig. 1), arising from that measurement, shows an endothermal effect which represents melting of the substance. USP Chapter <891> recommends to correlate the extrapolated onset temperature of the DSC effect (in the present case at 134.5°C) to the Melting Temperatures and EnthalpiesThe enthalpy of fusion of a substance, also known as latent heat, is a measure of the energy input, typically heat, which is necessary to convert a substance from solid to liquid state. The melting point of a substance is the temperature at which it changes state from solid (crystalline) to liquid (isotropic melt).melting point of the crystalline material. The term for that is the melt onset temperature. The corresponding melting enthalpy (or heat of fusion) is calculated by peak integration resulting in 159.6 J/g. Evaluation can be automatically run using the AutoEvaluation functionality of the NETZSCH Proteus® software. Both results agree well with the values given in literature (1) and (2).
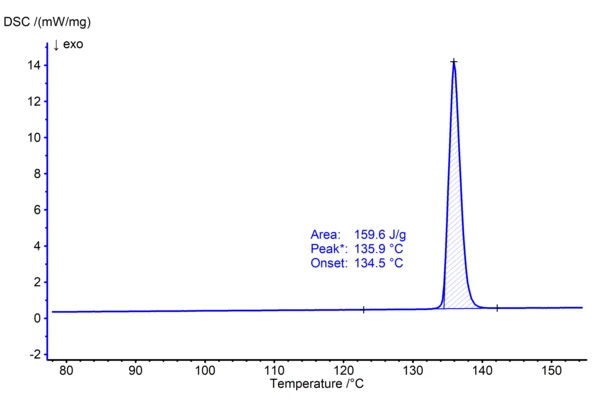
Literature: (1) H. Manzo, A.A. Ahumada,, J. Pharm. Sci., 1990, 79, 12, pp 1109 – 1115 (407.2 K) (2) A. Pen͂a, B. Excalera, A. Reillo, A.B. Sánchez, P. Bustamante, J. Pharm. Sci., 2009, 98, 3, pp 1129 – 1135 (28.75 kJ/mol, based on a molar mass of 179.21 g/mol).