
28.11.2022 by Dr. Elena Moukhina, Xu Liang (NETZSCH Scientific Instruments, Shanghai)
Ocena ryzyka termicznego w procesach chemicznych: Metody kinetyczne dla TD24
Chemiczne procesy przemysłowe oparte na reakcjach egzotermicznych mogą być bardzo niebezpieczne. Brak wiedzy na temat procesu może prowadzić do nieprawidłowych warunków procesu, a tym samym do niekontrolowanego wzrostu temperatury. Co więcej, awaria urządzenia chłodzącego może również prowadzić do dalszego wzrostu temperatury. Aby zapewnić bezpieczeństwo procesów, konieczne jest wcześniejsze ustalenie, czy wzrost temperatury jest nieszkodliwy, czy też jest początkiem ucieczki termicznej.
W przemyśle chemicznym często zachodzą wysokoenergetyczne reakcje syntezy z bardzo intensywnym wytwarzaniem ciepła. Takie procesy przemysłowe wymagają urządzeń chłodzących, które nie pozwalają na podgrzanie reagentów powyżej określonej temperatury. Temperatura reagentów podczas przetwarzania przemysłowego nazywana jest temperaturą procesu lub Tp. Aby wiedzieć, jak intensywne musi być chłodzenie, aby utrzymać temperaturę procesu, konieczne jest poznanie entalpii reakcji. W tym celu NETZSCH oferuje instrumenty termoanalityczne, takie jak różnicowy kalorymetr skaningowy (DSC) i kalorymetr przyspieszający (ARC®).
Charakterystyczne temperatury procesu
Jednak sama znajomość wartości entalpii nie zawsze wystarcza do zapewnienia bezpieczeństwa procesu chemicznego. Jeśli chłodzenie nie powiedzie się, kontynuowana reakcja zwiększy temperaturę w reaktorze, aż do zużycia reagentów. Wówczas reakcja i związane z nią samonagrzewanie zakończą się i osiągnięta zostanie teoretyczna temperatura końcowa. Temperatura ta nazywana jest maksymalną temperaturą reakcji syntezy (MTSR). MTSR jest podstawowym podejściem do oceny ryzyka ucieczki termicznej i projektowania bezpiecznych warunków pracy.
Bezpieczeństwo procesów przemysłowych zależy od tego, jak wysoka jest MTSR. Jeśli jest on zbyt wysoki, może zainicjować proces wtórny z dalszym samonagrzewaniem. Taką reakcją wtórną jest zazwyczaj Reakcja rozkładuReakcja rozkładu to wywołana termicznie reakcja związku chemicznego tworząca produkty stałe i/lub gazowe. reakcja rozkładu, która jest egzotermiczna i prowadzi do dalszego wzrostu temperatury. W rzeczywistości, jeśli zainicjowana zostanie szybka reakcja wtórna, ryzyko ucieczki i wybuchu termicznego jest bardzo wysokie.
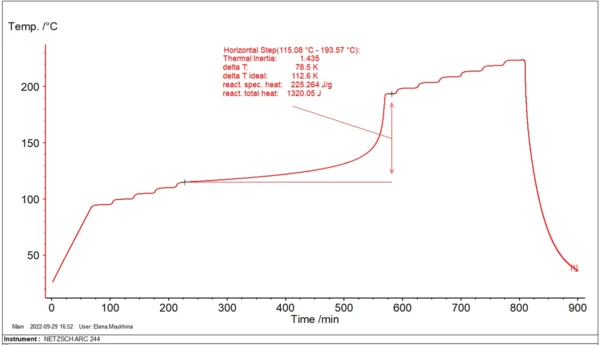
Podczas procesów przemysłowych w dużych reaktorach reagenty znajdują się w warunkach zbliżonych do adiabatycznych, gdzie rozwijająca się energia cieplna prowadzi do samonagrzewania się reagentów. Aby zbadać zachowanie materiału, system ARC® pozwala na stworzenie warunków adiabatycznych dla small ilości materiału. Rysunek 1 przedstawia przykład takiego pomiaru.
Wzrost temperatury reagentów podczas reakcji egzotermicznych w warunkach adiabatycznych przyspiesza z czasem, a następnie osiąga maksymalne tempo. Czas od początku procesu adiabatycznego do osiągnięcia maksymalnej szybkości reakcji nazywany jest czasem do osiągnięcia maksymalnej szybkości (TMR). Wartość czasu TMR zależy od temperatury początkowej. Im niższa temperatura początkowa, tym dłuższy jest ten czas.
Temperatura początkowa dla procesu adiabatycznego z TMR=24 godziny nazywana jest TD24. Odpowiada ona temperaturze, w której czas do osiągnięcia maksymalnej szybkości reakcji niekontrolowanej wynosi 24 godziny. Temperatura ta charakteryzuje proces i jest wykorzystywana do oceny ryzyka termicznego.
Porównanie charakterystycznych temperatur
Jeśli wartość MTSR jest niższa niżTD24, oznacza to, że po zakończeniu reakcji pierwotnej szybka reakcja wtórna nie jest inicjowana, a ryzyko niekontrolowanej reakcji jest niskie. Jeśli MTSR jest wyższa niżTD24, reakcja wtórna rozpoczyna się już podczas reakcji pierwotnej i niemożliwe jest uniknięcie niekontrolowanej reakcji, co może mieć niebezpieczne konsekwencje. Istnieje kilka pośrednich klas poziomów ryzyka między tymi dwoma przypadkami [1], które zależą od relacji między MTSR,TD24 i MAT (maksymalna osiągalna temperatura).
Kinetyczne metody obliczaniaTD24
TemperaturęTD24 można obliczyć za pomocą różnych metod kinetycznych w oparciu o dane eksperymentalne z przyrządów DSC lub ARC®.
Liniowa ekstrapolacja TMR
Jest to tradycyjny algorytm liniowy. Opiera się on na założeniu jednoetapowego procesu adiabatycznego z przybliżeniem dla reakcji zerowego rzędu, gdzie w głównym równaniu kinetycznym (1) wyrażenie typu reakcji f(α)=1.

Gdzie φ jest współczynnikiem bezwładności cieplnej, stosunkiem pojemności cieplnej materiału i zbiornika do pojemności cieplnej materiału Cp. W przypadku braku zbiornika φ=1.
ΔH to entalpia, A to wykładnik wstępny, Ea to energia aktywacji, a R to stała gazowa.
Przy takim założeniu można zastosować następujące przybliżenie liniowe:
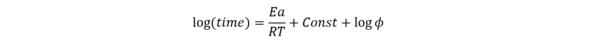
Zależność ta reprezentuje linię prostą log(czas) vs. 1/T, gdzie nachylenie Ea/R jest niezależne od współczynnika bezwładności cieplnej φ.
Jeśli eksperyment w ARC® zostanie przeprowadzony z φ>1, linia prosta dla φ=1 będzie równoległa, ale przesunięta w dół o log(φ). Następnie na nowej linii można znaleźć temperaturęTD24 dla czasu = 24 godziny.
Rys. 2 przedstawia przykład najprostszej aproksymacji liniowej do ocenyTD24.
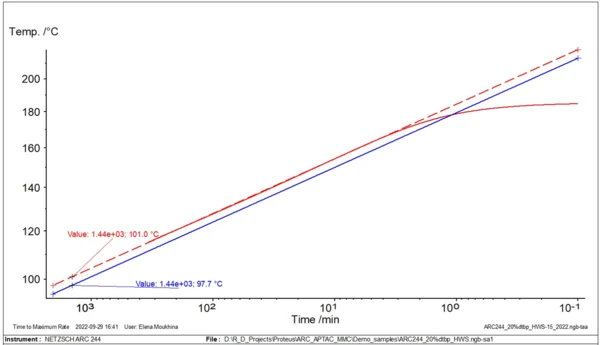
Do tego typu analizy i ocenyTD24 potrzebna jest tylko jedna krzywa eksperymentalna.
Nieliniowa ekstrapolacja TMR
W rzeczywistości jednak Reakcja rozkładuReakcja rozkładu to wywołana termicznie reakcja związku chemicznego tworząca produkty stałe i/lub gazowe. reakcja rozkładu może być niezerowego rzędu lub może mieć kilka etapów reakcji. Dlatego proponujemy drugą, dokładniejszą metodę nieliniową [2]. Metoda ta zakłada, że początkowa część reakcji przebiega zgodnie z reakcją n-tego rzędu i umożliwia znalezienie energii aktywacji Ea. Następnie metoda bezmodelowa jest wykorzystywana do obliczania adiabatycznego samonagrzewania dla φ=1 z danych eksperymentalnych, z φ>1 uzyskanym przez pomiar pokazany na rysunku 1.
Metoda ta działa dla reakcji z dowolnymi typami reakcji mającymi początkową część przypominającą reakcję n-tego rzędu, jak również dla reakcji mających kilka następujących po sobie etapów reakcji.
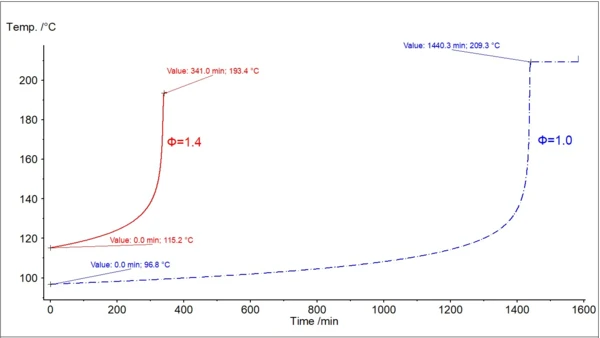
Na rys. 3 pokazano dwie krzywe temperatury z samonagrzewaniem: oryginalne dane eksperymentalne z φ=1,435 i nową obliczoną krzywą z φ=1. Ważną temperaturą dla oceny bezpieczeństwa jest tak zwana temperaturaTD24. Odpowiada ona temperaturze, w której czas do osiągnięcia maksymalnej szybkości reakcji niekontrolowanej wynosi 24 godziny. Czas potrzebny do osiągnięcia maksymalnej szybkości w warunkach adiabatycznych jest znany jako TMR, czas do maksymalnej szybkości. Ta druga krzywa jest używana do znalezienia temperaturyTD24.
Advanced Kinetics by Kinetics Neo Software
Obie opisane powyżej metody opierają się na założeniu, że energia aktywacji jest wartością stałą.
Proces może jednak zawierać etapy o różnych energiach aktywacji i etapy reakcji różne od reakcji n-tego rzędu. Najdokładniejsza analiza kinetyczna z bardziej precyzyjnie przewidywaną wartościąTD24 wymaga zestawów danych z kilku eksperymentów przeprowadzonych w różnych warunkach temperaturowych. Dane z kilku eksperymentów są obowiązkowym warunkiem dokładnej analizy kinetycznej, zgodnie z zaleceniami ICTAC [3].
W tym przypadku można przeprowadzić kilka eksperymentów DSC przy różnych szybkościach ogrzewania lub w różnych temperaturach izotermicznych. Alternatywnie, można przeprowadzić kilka eksperymentów ARC® z różnymi współczynnikami φ. Eksperymenty te mogą mieć różne wartości konwersji w tej samej temperaturze uzyskane z różnych pomiarów. Narzędziem do dokładnej analizy kinetycznej jest NETZSCH Oprogramowanie Kinetics Neo obejmujące zarówno metody kinetyczne wolne od modeli, jak i oparte na modelach. Metody oparte na modelach mogą pomóc w określeniu liczby etapów reakcji, a także parametrów kinetycznych dla każdej indywidualnej reakcji. Zastosowanie zaawansowanej analizy kinetycznej obejmuje stworzenie jednego modelu kinetycznego, który matematycznie składa się z układu równań kinetycznych z zestawem parametrów kinetycznych niezależnych od czasu i temperatury. Jeśli krzywe symulowane przez ten jeden model są w dobrej zgodności z danymi eksperymentalnymi zmierzonymi w różnych warunkach temperaturowych, model ten może być wykorzystany do symulacji zachowania materiału i szybkości reakcji w warunkach temperaturowych innych niż istniejące eksperymenty, takich jak obliczanie wzrostu temperatury dla warunków adiabatycznych iTD24.
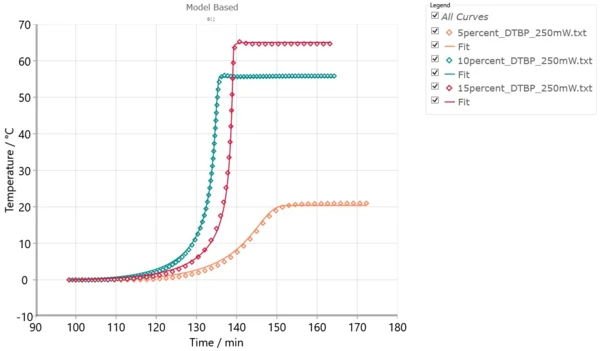
Rys. 4 przedstawia zestaw eksperymentów ARC® w różnych warunkach temperaturowych i symulowane krzywe dla tych warunków. Dobra zgodność między modelem a eksperymentami pozwala na zastosowanie tego modelu dla innych temperatur.
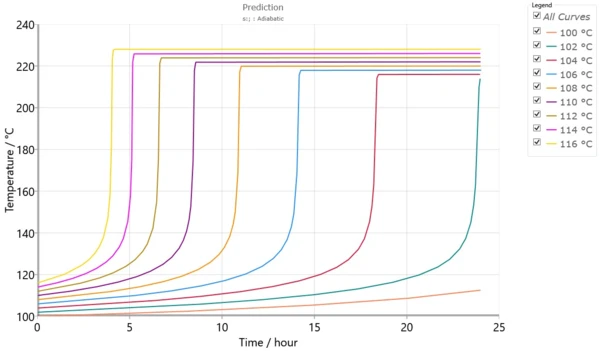
Rys. 5 przedstawia zestaw symulowanych krzywych adiabatycznych obliczonych przy użyciu modelu kinetycznego z rys. 4. Oprócz symulowanych krzywych adiabatycznych, oprogramowanie może obliczyćTD24, która jest początkową temperaturą procesu adiabatycznego w celu osiągnięcia TMR w ciągu 24 godzin.
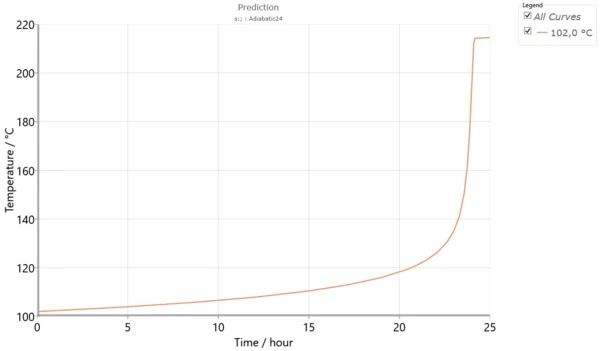
Rys. 6 przedstawia temperaturęTD24 dla warunków adiabatycznych.
Wnioski:
Rozważane metody kinetyczne, od prostych liniowych do zaawansowanych, mogą przyczynić się do obliczenia temperaturyTD24 wymaganej do oceny ryzyka termicznego.
Porównanie wyników uzyskanych za pomocą różnych metod pozwala albo na potwierdzenie założeń przewidywań liniowych i nieliniowych, albo na odrzucenie tych założeń. Ponadto można przeprowadzić dodatkowe eksperymenty w celu udoskonalenia wyników za pomocą zaawansowanych analiz kinetycznych w oprogramowaniu Kinetics Neo.
Pobierz bezpłatną wersję próbną: Kinetic - NETZSCH Kinetic
Referencje:
1.bezpieczeństwo termiczne procesów chemicznych: Ocena ryzyka i projektowanie procesów, Francis Stoessel (Szwajcaria 2008)
2.harsNet. Sieć tematyczna oceny zagrożeń systemów wysoce reaktywnych. 6. Kalorymetria adiabatyczna.
https://fdocuments.net/document/6-adiabatic-calorimetry-calorimetrypdfharsnet-thematic-network-on-hazard-assessment.html?page=1
3.s. Vyazovkin, ICTAC Kinetics Committee recommendations for analysis of multi-step kinetics, Thermochimica Acta, V689, lipiec 2020, 178597, https://doi.org/10.1016/j.tca.2020.178597



