
27.04.2023 by Dr. Elena Moukhina, Xu Liang (NETZSCH Scientific Instruments, Shanghai)
Oznaczanie TD24 za pomocą przyrządów ARC® do oceny ryzyka termicznego w procesach chemicznych
Chemiczne procesy przemysłowe oparte na reakcjach egzotermicznych mogą być bardzo niebezpieczne. Brak wiedzy na temat procesu może prowadzić do nieprawidłowych warunków procesu, a tym samym do ucieczki termicznej w urządzeniach lub reaktorach. Co więcej, awaria urządzenia chłodzącego może również prowadzić do nieplanowanego wzrostu temperatury w reaktorze. Aby zapewnić bezpieczeństwo procesów, konieczne jest wcześniejsze ustalenie, czy taki wzrost temperatury jest nieszkodliwy, czy też stanowi początek niekontrolowanego wzrostu temperatury.
W przemyśle chemicznym często przeprowadza się wysokoenergetyczne reakcje syntezy z bardzo intensywnym wytwarzaniem ciepła. Takie procesy przemysłowe wymagają urządzeń chłodzących, które nie pozwalają na podgrzanie reagentów powyżej zamierzonej temperatury syntezy. Temperatura reagentów podczas przetwarzania przemysłowego nazywana jest temperaturą procesu lub Tp. Aby wiedzieć, jak intensywne musi być chłodzenie, aby utrzymać temperaturę procesu, konieczna jest znajomość ciepła reakcji, wzrostu temperatury i kinetyki reakcji.
Rozwiązanie: Pomiary za pomocą kalorymetru przyspieszającego ARC® 305
NETZSCH oferuje kalorymetry przyspieszające (ARCs, rysunek 1) do badania reakcji samonagrzewania i ich charakterystyki. Najnowszym i najbardziej inteligentnym z nich jest niedawno zoptymalizowany kalorymetr ARC® 305. Określenie charakterystycznych temperatur, takich jakTD24 (1), można wykonać za pomocą standardowego oprogramowania do prostych reakcji n-tego rzędu lub zaawansowanego oprogramowania Kinetics Neo do złożonych reakcji wieloetapowych lub reakcji z autokatalizą.
(1) TD24: Temperatura początkowa dla procesu adiabatycznego z czasem do maksymalnej szybkości (TMR) = 24 godziny nazywana jest TD24.

Charakterystyczne temperatury procesu w przemysłowym procesie chemicznym - unikanie niekontrolowanego wzrostu temperatury
Znajomość mierzonych wartości, takich jak ciepło reakcji, jest bardzo ważna, ale nie zawsze wystarczająca dla bezpiecznego procesu chemicznego. Jeśli chłodzenie nie powiedzie się, trwająca reakcja zwiększy temperaturę w reaktorze, aż do zużycia reagentów. Wówczas reakcja i związane z nią samonagrzewanie zakończą się, a końcowa teoretyczna temperatura zostanie osiągnięta. Temperatura ta nazywana jest maksymalną temperaturą reakcji syntezy (MTSR). MTSR jest podstawowym podejściem do oceny ryzyka ucieczki termicznej i projektowania bezpiecznych warunków pracy.
Bezpieczeństwo procesów przemysłowych zależy od tego, jak wysoka jest MTSR. Jeśli jest on zbyt wysoki, może zainicjować procesy wtórne z dalszym samonagrzewaniem. Takie kolejne reakcjesą zwykle reakcjami rozkładu, które są egzotermiczne i prowadzą do dalszego wzrostu temperatury. W rzeczywistości, jeśli takie reakcje wtórne zostaną zainicjowane, ryzyko ucieczki i wybuchu termicznego jest bardzo wysokie.
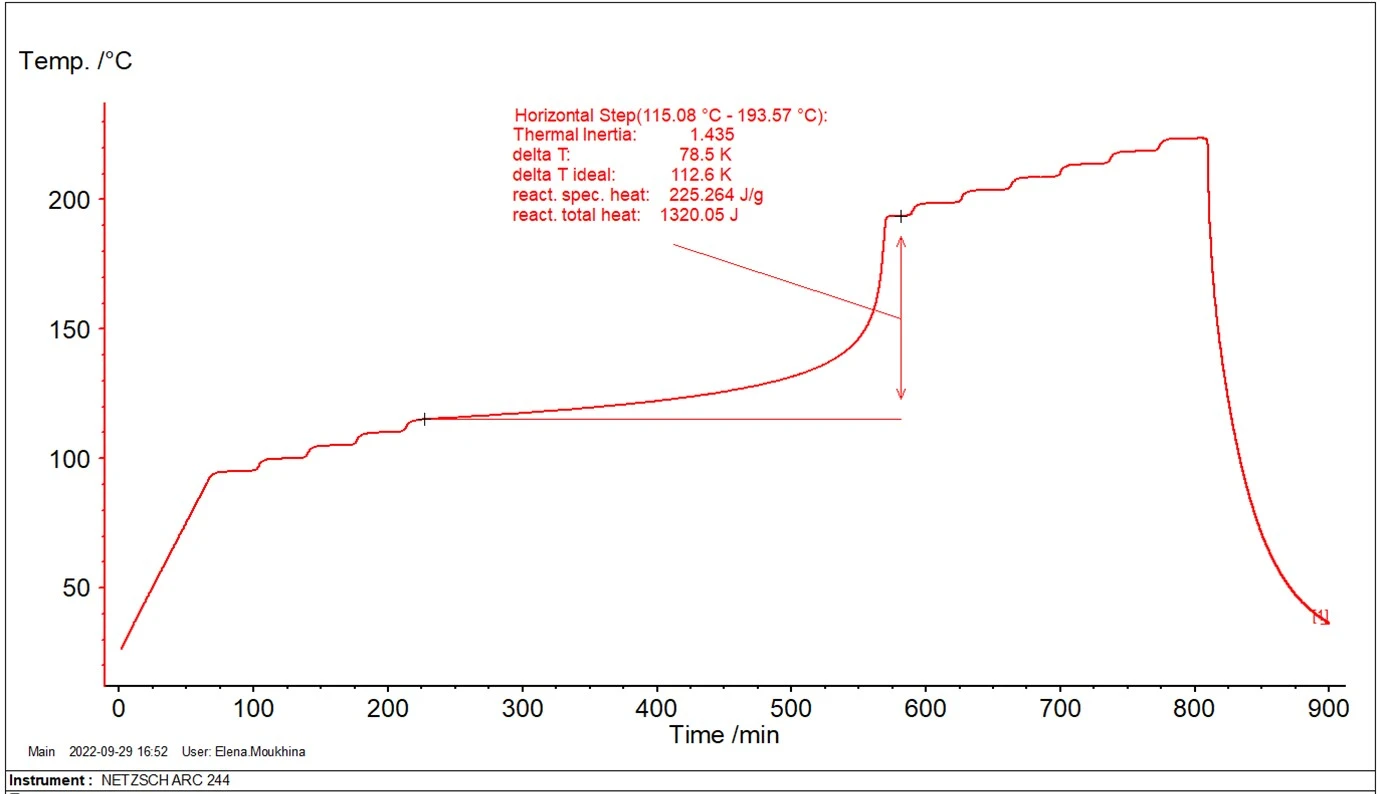
Podczas procesów przemysłowych w reaktorach objętościowych large, reagenty znajdują się w warunkach zbliżonych do adiabatycznych, gdzie rozwijające się ciepło reakcji prowadzi do samonagrzewania się reagentów. W celu zbadania zachowania materiału, system ARC® pozwala na stworzenie warunków adiabatycznych dla small ilości próbki materiału. Rysunek 2 przedstawia przykład takiego pomiaru.
Czas do maksymalnej szybkości
Wzrost temperatury reagentów podczas reakcji egzotermicznych w warunkach adiabatycznych przyspiesza z czasem; następnie osiąga maksymalną szybkość. Czas od początku procesu adiabatycznego do osiągnięcia maksymalnej szybkości reakcji nazywany jest czasem do osiągnięcia maksymalnej szybkości (TMR). Wartość tego czasu zależy od temperatury początkowej: Im niższa temperatura początkowa, tym dłuższy jest ten czas.
Temperatura początkowa dla procesu adiabatycznego z TMR=24 godziny nazywana jest TD24. Odpowiada ona temperaturze, w której czas do osiągnięcia maksymalnej szybkości reakcji niekontrolowanej (szybkość niekontrolowanej reakcji termicznej) wynosi 24 godziny. Temperatura ta charakteryzuje proces i jest wykorzystywana do oceny ryzyka termicznego.
Porównanie charakterystycznych temperatur
Jeśli wartość MTSR jest niższa niżTD24, oznacza to, że temperatura nie jest wystarczająca do zainicjowania procesu wtórnego, takiego jak Reakcja rozkładuReakcja rozkładu to wywołana termicznie reakcja związku chemicznego tworząca produkty stałe i/lub gazowe. reakcja rozkładu, a ryzyko niekontrolowanej reakcji jest niskie. Jeśli MTSR jest wyższy niżTD24, reakcja wtórna rozpoczyna się już podczas reakcji pierwotnej i niemożliwe jest uniknięcie ucieczki, co może mieć niebezpieczne konsekwencje. Istnieje kilka pośrednich klas poziomów ryzyka między tymi dwoma przypadkami [1], które zależą od relacji między MTSR,TD24 i MTT (maksymalna temperatura techniczna).
Kinetyczne metody obliczaniaTD24
TemperaturęTD24 można obliczyć za pomocą różnych modeli kin etycznych opartych na danych eksperymentalnych z instrumentów ARC®. TemperaturęTD24 można obliczyć za pomocą różnych modeli kinetycznych w oparciu o dane eksperymentalne uzyskane z pomiarów ARC®.
Liniowa ekstrapolacja TMR
Jest to tradycyjny algorytm liniowy. Opiera się on na założeniu jednoetapowego procesu adiabatycznego z przybliżeniem do reakcji zerowego rzędu, gdzie w głównym równaniu kinetycznym (1) typ reakcji f(α)=1.

Tutaj φ jest współczynnikiem bezwładności cieplnej, tj. stosunkiem pojemności cieplnej materiału z naczyniem do pojemności cieplnej materiału Cp. W przypadku braku zbiornika, φ=1. ΔH jest entalpią, A jest wykładnikiem wstępnym, Ea jest energią aktywacji, a R jest stałą gazową. Przy takim założeniu można zastosować następujące przybliżenie liniowe:
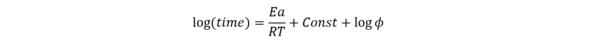
Zależność ta odpowiada linii prostej log (czas) vs. 1/T, gdzie nachylenie Ea/R jest niezależne od współczynnika bezwładności cieplnej φ.
Rysunek 3 przedstawia przykład najprostszego liniowego przybliżenia do ocenyTD24. Jeśli eksperyment jest przeprowadzany w ARC® z φ>1 (czerwona linia ciągła), ekstrapolacja do 24 godzin daje czerwoną linię przerywaną. Ekstrapolowana linia prosta dla φ = 1 (niebieska) biegnie równolegle, ale jest przesunięta o logarytm (φ) do niższych temperatur. Następnie na nowej czerwonej przerywanej linii można znaleźć temperaturęTD24 dla czasu = 24 godziny.
Do tego typu analizy i ocenyTD24 wymagany jest tylko jeden zestaw danych eksperymentalnych z pomiaru ARC®.
Nieliniowa ekstrapolacja TMR
W rzeczywistości jednak Reakcja rozkładuReakcja rozkładu to wywołana termicznie reakcja związku chemicznego tworząca produkty stałe i/lub gazowe. reakcja rozkładu może mieć inne rzędy reakcji oprócz rzędu zerowego oraz, oprócz mechanizmu jednoetapowego, także wiele etapów reakcji.
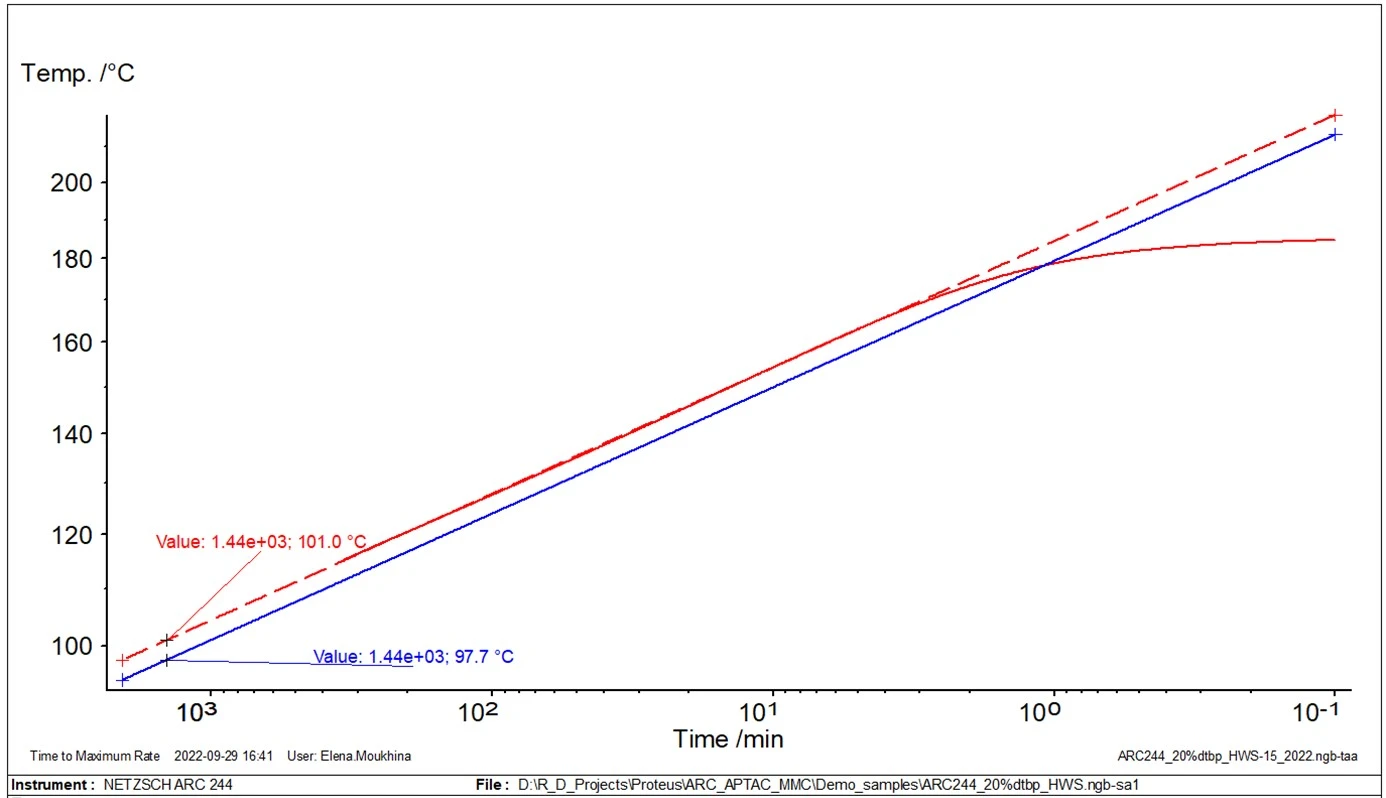
Dla takich przypadków opracowaliśmy drugą, bardziej precyzyjną metodę nieliniową [2]. Metoda ta zakłada, że początkowa część reakcji przebiega zgodnie z reakcją n-tego rzędu i umożliwia znalezienie energii aktywacji, Ea. Następnie metoda bezmodelowa jest wykorzystywana do obliczania adiabatycznego samonagrzewania dla φ=1 z danych eksperymentalnych, z φ>1 uzyskanym przez pomiar pokazany na rysunku 2.
Metoda ta działa zarówno dla reakcji z dowolnym typem reakcji o początkowej części przypominającej reakcję n-tego rzędu, jak i dla reakcji z wieloma kolejnymi etapami reakcji.
Na rysunku 4 przedstawiono dwie krzywe temperatury z samonagrzewaniem: oryginalne dane eksperymentalne z φ=1,435 (krzywa czerwona) oraz nowo obliczoną krzywą z φ=1 (krzywa niebieska). Ważną temperaturą dla oceny bezpieczeństwa jest tak zwana temperaturaTD24. Odpowiada ona temperaturze, w której czas do osiągnięcia maksymalnej szybkości reakcji niekontrolowanej wynosi 24 godziny. Czas potrzebny do osiągnięcia maksymalnej szybkości w warunkach adiabatycznych jest znany jako TMR, czas do maksymalnej szybkości. Ta druga krzywa, skorygowana do φ=1 (niebieska), jest używana do znalezienia temperaturyTD24.
Advanced Kinetics by Kinetics Neo Software
Obie opisane powyżej metody opierają się na założeniu, że energia aktywacji jest wartością stałą. Proces może jednak zawierać etapy o różnych energiach aktywacji i etapy reakcji różne od reakcji n-tego rzędu. Najdokładniejsza analiza kinetyczna z bardziej precyzyjnie przewidywaną wartościąTD24 wymaga zestawów danych z kilku eksperymentów przeprowadzonych w różnych warunkach. Posiadanie danych z wielu eksperymentów jest obowiązkowym warunkiem dokładnej analizy kinetycznej, zgodnie z zaleceniami ICTAC [3].
W przypadku tej zaawansowanej oceny można przeprowadzić kilka eksperymentów ARC® przy różnych współczynnikach φ. W przypadku tych eksperymentów różne wartości konwersji uzyskuje się poprzez różne pomiary w tej samej temperaturze. Narzędziem do tej dokładnej analizy kinetycznej jest NETZSCH Oprogramowanie Kinetics Neoktóre obejmuje zarówno metody kinetyczne bez użycia modeli, jak i oparte na modelach. Metody oparte na modelach mogą pomóc w określeniu liczby etapów reakcji, a także parametrów kinetycznych dla każdej indywidualnej reakcji. Zastosowanie zaawansowanej analizy kinetycznej obejmuje utworzenie pojedynczego modelu kinetycznego, który matematycznie składa się z układu różniczkowych równań kinetycznych z zestawem parametrów kinetycznych niezależnych od czasu i temperatury. Jeśli krzywe symulowane przez ten jeden model są w dobrej zgodności z danymi eksperymentalnymi zmierzonymi w różnych warunkach, model ten może być wykorzystany do symulacji zachowania materiału i szybkości reakcji w warunkach temperaturowych innych niż te z poprzednich eksperymentów, takich jak obliczanie wzrostu temperatury w warunkach adiabatycznych iTD24.
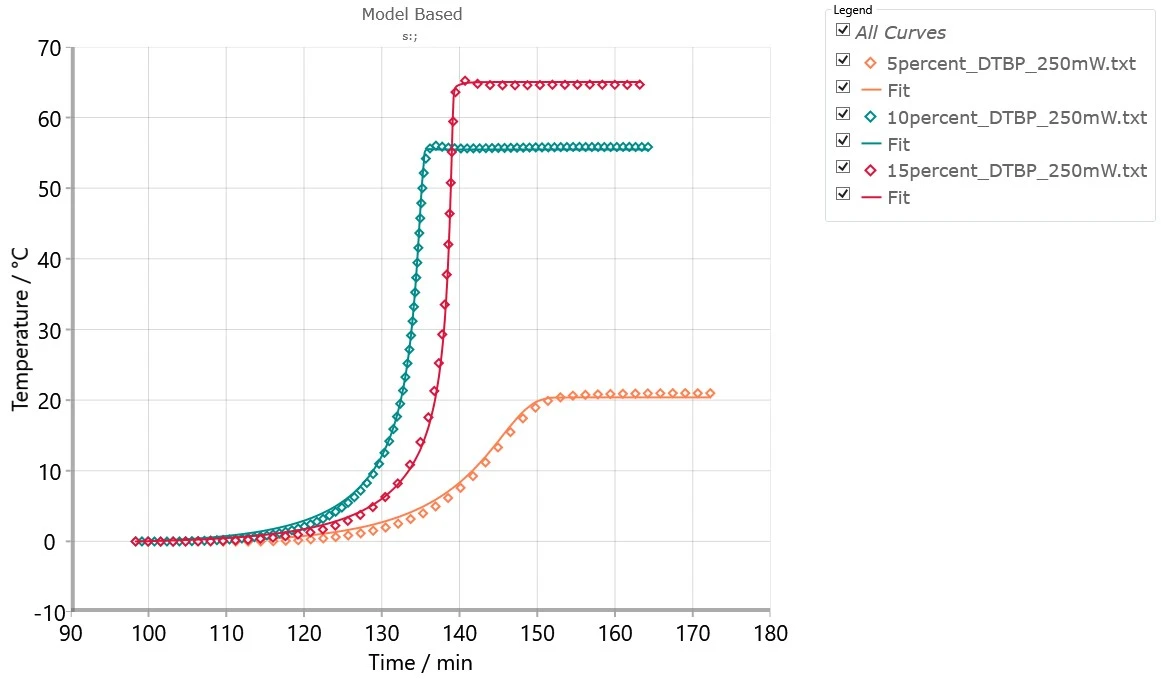
Rysunek 5 przedstawia zestaw eksperymentów ARC® w różnych warunkach i symulowane krzywe dla tych warunków. Dobra zgodność między modelem a eksperymentami pozwala na zastosowanie tego modelu dla innych temperatur i bezwładności cieplnej.
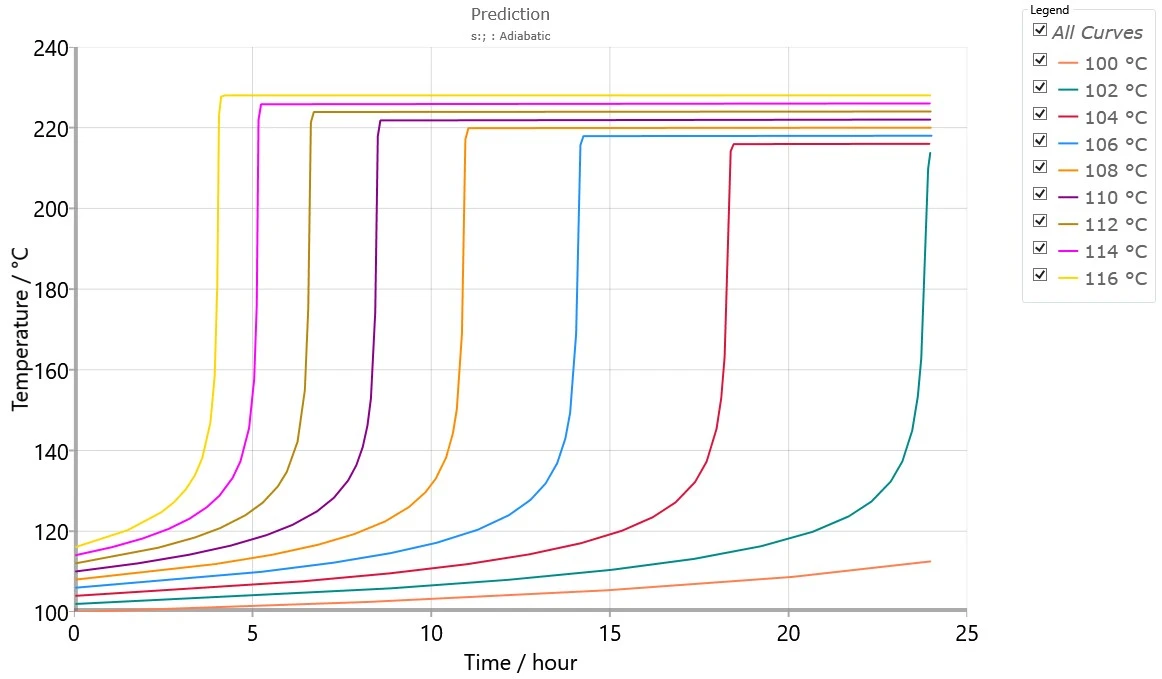
Na rysunku 6 przedstawiono symulację, w której badana substancja jest poddawana obróbce izotermicznej w różnych temperaturach ekspozycji, które zostały obliczone za pomocą modelu kinetycznego z rysunku 5. Oprócz symulowanych krzywych adiabatycznych, oprogramowanie może obliczyćTD24, czyli początkową temperaturę procesu adiabatycznego potrzebną do osiągnięcia TMR w ciągu 24 godzin.
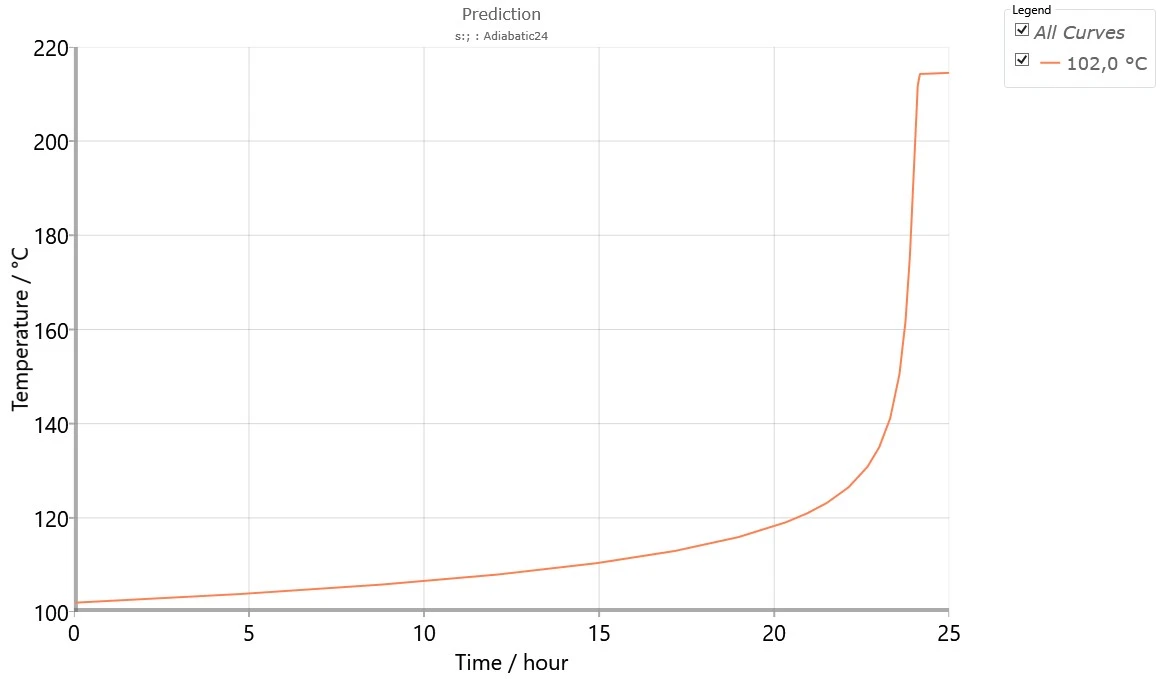
Rysunek 7 przedstawia przebieg samonagrzewania próbki w warunkach adiabatycznych w celu usunięcia z obróbki termicznej w temperaturze 102°C przez 24 godziny.
Wnioski:
Reakcje samonagrzewania mogą być badane poprzez eksperymenty za pomocą NETZSCH ARC® instrumentów - od prostych liniowych Proteus® do bardziej zaawansowanych obliczeń przy użyciu oprogramowania Kinetics Neo. Pozwala to na obliczenie temperaturyTD24 nawet w przypadku bardziej złożonych przebiegów reakcji, co ma zasadnicze znaczenie dla oceny ryzyka termicznego. Porównanie wyników uzyskanych różnymi metodami pozwala na potwierdzenie lub odrzucenie założeń dotyczących przewidywań liniowych i nieliniowych, a także na przeprowadzenie dodatkowych eksperymentów. Te z kolei pozwalają na zwiększenie głębokości badania i udoskonalenie wyników za pomocą zaawansowanej analizy kinetycznej w oprogramowaniu Kinetics Neo.
Odniesienia:
- Bezpieczeństwo termiczne procesów chemicznych: Ocena ryzyka i projektowanie procesów, Francis Stoessel (Szwajcaria 2008)
- HarsNet. Sieć tematyczna oceny zagrożeń systemów wysoce reaktywnych. 6. Kalorymetria adiabatyczna.
https://fdocuments.net/document/6-adiabatic-calorimetry-calorimetrypdfharsnet-thematic-network-on-hazard-assessment.html?page=1 - S. Vyazovkin, ICTAC Kinetics Committee recommendations for analysis of multi-step kinetics, Thermochimica Acta, V689, lipiec 2020, 178597, https://doi.org/10.1016/j.tca.2020.178597


